题目内容
【题目】二甲醚是一种清洁能源,用水煤气制取甲醚的原理如下:
I.![]()
II.![]()
(1)则![]() 的△H= ________(用△H1、△H2表示)
的△H= ________(用△H1、△H2表示)
(2)300℃和500℃时,反应I的平衡常数分别为K1、K2,且K1>K2,则其正反应为______反应(填”吸热”’或”放热”)。
(3)在恒容密闭容器中发生反应I:
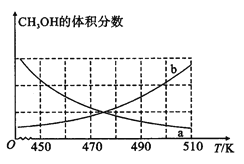
①如图能正确反映体系中甲醇体积分数随温度变化情况的曲线是____(填“a”或“b”)。
②下列说法能表明反应已达平衡状态的是____(填标号)。
A.容器中气体的压强不再变化 B.混合气体的密度不再变化
C.混合气体的平均相对分子质量不再变化 D.v正(H2)=2v正(CH3OH)
(4)500K时,在2L密闭容器中充入4molCO和8molH2,4min达到平衡,平衡时CO的转化率为80%,且2c(CH3OH)=c(CH3OCH3),则:
① 0~4min,反应I的v(H2)=________,反应I的平衡常数K=________。
②反应II中CH3OH的转化率α=_________。
【答案】2△H1+△H2 放热 a AC 0.8mol/(L·min) 1.25(mol/L)-2 80%
【解析】
(1)目标方程式![]() 可由I式×2+II式得到,根据盖斯定律,该反应的△H=2△H1+△H2;
可由I式×2+II式得到,根据盖斯定律,该反应的△H=2△H1+△H2;
(2)升高温度平衡常数减小,正反应为放热反应;
(3)①正反应放热,升高温度平衡向逆反应方向进行,甲醇的体积分数减小,因此能正确反映体系中甲醇体积分数随温度变化情况的曲线是a;
②A. 正反应气体体积减小,容器中气体的压强不再变化,说明反应达到平衡,A正确;
B. 密度是混合气体的质量和容器容积的比值,根据质量守恒定律,该反应气体的质量不会变化,且容器体积也不会变化,则密度不是变量,因此不能说明,B错误;
C. 混合气体的平均相对分子质量是混合气体总质量与其总物质的量的比值,质量比变,但是物质的量会发生变化,故该物理量为变量,不变时可以说明反应达到平衡,C正确;
D. v正(H2)=2v正(CH3OH)表示的均为正反应的方向,不能说明反应达到平衡,D错误;
故答案选AC;
(4)①4min达到平衡,平衡时CO的转化率为80%,则消耗CO3.2mol,因此消耗氢气6.4mol,消耗氢气的浓度为3.2mol/L,0-4min,反应I的v(H2)=![]() ;剩余CO的浓度为0.4mol/L,氢气0.8mol/L,最初生成甲醇1.6mol/L,设甲醇分解了x,生成二甲醚0.5x,
;剩余CO的浓度为0.4mol/L,氢气0.8mol/L,最初生成甲醇1.6mol/L,设甲醇分解了x,生成二甲醚0.5x,![]() ,解得x=1.28,平衡常数
,解得x=1.28,平衡常数![]() ;
;
②反应II中甲醇的转化率![]() 。
。

 课程达标测试卷闯关100分系列答案
课程达标测试卷闯关100分系列答案 新卷王期末冲刺100分系列答案
新卷王期末冲刺100分系列答案 全能闯关100分系列答案
全能闯关100分系列答案【题目】下图是元素周期表的一部分,表中的①~⑩中元素,用元素符号或化学式填空回答:
族 周 期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
二 | ① | ② | ||||||
三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
四 | ⑨ | ⑩ |
(1)在这些元素中,化学性质最不活泼的原子的原子结构示意图为____________
(2)⑦的黄绿色单质的化学式为____________⑩的单质在常温下的存在状态为____________
(3)①的气态氢化物的水溶液显_______
(4)用电子式表示②与④形成化合物的过程______
(5)这些元素中的最高价氧化物对应的水化物中,碱性最强的是__呈两性的是__
(6)写出⑤与盐酸反应的化学方程式:__________________________写出⑤的氢氧化物与氢氧化钠溶液反应的离子方程式:______
【题目】某课外活动小组欲利用CuO与NH3反应,研究NH3的某种性质并测定其组成,设计了如下实验装置(夹持装置未画出)进行实验。请回答下列问题:

(1)仪器a的名称为____,仪器b中可选择的试剂为____。
(2)实验室中,利用装置A,还可制取的无色气体是____(填字母)。
A.Cl2 | B.O2 | C.CO2 | D.NO2 |
(3)实验中观察到装置C中黑色CuO粉末变为红色固体,量气管有无色无味的气体产生,上述现象证明NH3具有____性,写出相应的化学方程式:_______________________。
(4)E装置中浓硫酸的作用是_____________________________________。
(5)读取气体体积前,应对装置F进行的操作:____________________________。
(6)实验完毕,若测得干燥管D增重m g,装置F测得气体的体积为n L(已折算成标准状况),则氨分子中氮、氢的原子个数比为____(用含m、n字母的代数式表示)。