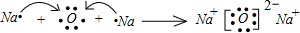题目内容
①②③④⑤五种元素,在元素周期表中的位置如图所示.回答下列问题

(1)①②③④⑤五种元素中,金属性最强的元素是
(2)元素②的最高价氧化物对应的水化物的电子式为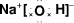
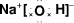 ,试比较②和③原子半径的大小②
,试比较②和③原子半径的大小②
(3)画出元素④的原子结构示意图
 ,该元素的最高价氧化物的水化物能与Cu发生反应,反应中作氧化剂的是(写化学式)
,该元素的最高价氧化物的水化物能与Cu发生反应,反应中作氧化剂的是(写化学式)
(4)写出元素⑤在周期表中的位置
(5)现有甲、乙两种短周期元素,室温下,甲元素单质在冷的浓硫酸或空气中,表面都生成致密的氧化膜,乙元素原子核外L层电子数是M层电子数的4倍.
①甲、乙元素分别为
②写出②的最高价氧化物对应的水化物与甲的最高价氧化物反应的离子方程式
(6)已知破坏1mol N≡N键、H-H键、N-H键分别需要吸收的能量为946kJ、436kJ、391kJ.则1molN2完全反应转化为NH3共

(1)①②③④⑤五种元素中,金属性最强的元素是
钠
钠
(写元素名称),该元素的单质在空气中燃烧的化学方程式为2Na+O2
Na2O2
| ||
2Na+O2
Na2O2
.
| ||
(2)元素②的最高价氧化物对应的水化物的电子式为
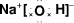
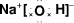
>
>
③(填“>”或“<”)(3)画出元素④的原子结构示意图


HNO3
HNO3
.(4)写出元素⑤在周期表中的位置
第三周期ⅦA 族
第三周期ⅦA 族
,以海水中含量最大的物质为原料可以生产⑤的单质,同时还可以得到另外两种重的工业原料,该反应的化学方程式为2NaCl+2H2O
Cl2↑+H2↑+2NaOH
| ||
2NaCl+2H2O
Cl2↑+H2↑+2NaOH
.
| ||
(5)现有甲、乙两种短周期元素,室温下,甲元素单质在冷的浓硫酸或空气中,表面都生成致密的氧化膜,乙元素原子核外L层电子数是M层电子数的4倍.
①甲、乙元素分别为
铝
铝
、镁
镁
写元素名称)②写出②的最高价氧化物对应的水化物与甲的最高价氧化物反应的离子方程式
2NaOH+Al2O3=2NaAlO2+H2O
2NaOH+Al2O3=2NaAlO2+H2O
(6)已知破坏1mol N≡N键、H-H键、N-H键分别需要吸收的能量为946kJ、436kJ、391kJ.则1molN2完全反应转化为NH3共
放出
放出
(填“吸收”或“放出”)能量92
92
kJ.分析:根据元素所在周期表中的位置可知:①为H元素,②为Na元素,③为C元素,④为N元素,⑤为Cl元素;
(1)根据金属性的递变规律判断金属性的强弱;
(2)根据原子核外电子层数的多少比较原子半径;
(3)根据反应中元素的化合价的变化判断氧化剂和还原剂;
(4)根据元素所在的横行和纵行判断元素的位置,电解饱和食盐水的产物为氢氧化钠、氢气和氯气;
(5)①甲元素单质在冷的浓硫酸或空气中,表面都生成致密的氧化膜,发生钝化反应,应为铝单质,乙元素原子核外L层电子数是M层电子数的4倍,应为镁元素;
②根据氧化铝为两性氧化物分析;
(6)根据反应热等于反应物的总键能减去生成物的总键能计算反应热.
(1)根据金属性的递变规律判断金属性的强弱;
(2)根据原子核外电子层数的多少比较原子半径;
(3)根据反应中元素的化合价的变化判断氧化剂和还原剂;
(4)根据元素所在的横行和纵行判断元素的位置,电解饱和食盐水的产物为氢氧化钠、氢气和氯气;
(5)①甲元素单质在冷的浓硫酸或空气中,表面都生成致密的氧化膜,发生钝化反应,应为铝单质,乙元素原子核外L层电子数是M层电子数的4倍,应为镁元素;
②根据氧化铝为两性氧化物分析;
(6)根据反应热等于反应物的总键能减去生成物的总键能计算反应热.
解答:解:根据元素所在周期表中的位置可知:①为H元素,②为Na元素,③为C元素,④为N元素,⑤为Cl元素
(1)同周期中元素的金属性从左到右逐渐减弱,同主族元素的金属性从上到下逐渐增强,则金属性最强为Na,在氧气中燃烧的化学方程式为2Na+O2
Na2O2,
故答案为:钠;2Na+O2
Na2O2;
(2)元素②的最高价氧化物对应的水化物为NaOH,为离子化合物,电子式为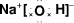 ,钠的原子核外有3个电子层,C的原子核外有2个电子层,核外电子层数越多,半径越大,故答案为:
,钠的原子核外有3个电子层,C的原子核外有2个电子层,核外电子层数越多,半径越大,故答案为: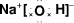 ;>;
;>;
(3)④为N元素,原子核外有2个电子层,最外层电子数为5,原子结构示意图为 ,其对应的最高价氧化物的水化物为HNO3,具有强氧化性,与铜反应时做氧化剂,
,其对应的最高价氧化物的水化物为HNO3,具有强氧化性,与铜反应时做氧化剂,
故答案为: ;HNO3;
;HNO3;
(4)⑤为Cl元素,原子核外有3个电子层,最外层电子数为7,所以在第三周期ⅦA族,电解饱和食盐水的产物为氢氧化钠、氢气和氯气,反应的方程式为
2NaCl+2H2O
Cl2↑+H2↑+2NaOH,故答案为:第三周期ⅦA族;2NaCl+2H2O
Cl2↑+H2↑+2NaOH;
(5)①甲元素单质在冷的浓硫酸或空气中,表面都生成致密的氧化膜,发生钝化反应,应为铝单质,乙元素原子核外L层电子数是M层电子数的4倍,应为镁元素,故答案为:铝;镁;
②②的最高价氧化物对应的水化物与甲的最高价氧化物的反应为氢氧化钠和氧化铝的反应,氧化铝为两性氧化物,与氢氧化钠反应生成偏铝酸钠和水,反应的化学方程式为
2NaOH+Al2O3=2NaAlO2+H2O,故答案为:2NaOH+Al2O3=2NaAlO2+H2O;
(6)反应的方程式为:N2+3H2═2NH3,1molN2完全反应转化为NH3的反应热为:946kJ+3×436kJ-6×391kJ=-92kJ,所以反应放出热量,故答案为:放出;92.
(1)同周期中元素的金属性从左到右逐渐减弱,同主族元素的金属性从上到下逐渐增强,则金属性最强为Na,在氧气中燃烧的化学方程式为2Na+O2
| ||
故答案为:钠;2Na+O2
| ||
(2)元素②的最高价氧化物对应的水化物为NaOH,为离子化合物,电子式为
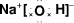 ,钠的原子核外有3个电子层,C的原子核外有2个电子层,核外电子层数越多,半径越大,故答案为:
,钠的原子核外有3个电子层,C的原子核外有2个电子层,核外电子层数越多,半径越大,故答案为: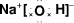 ;>;
;>;(3)④为N元素,原子核外有2个电子层,最外层电子数为5,原子结构示意图为
 ,其对应的最高价氧化物的水化物为HNO3,具有强氧化性,与铜反应时做氧化剂,
,其对应的最高价氧化物的水化物为HNO3,具有强氧化性,与铜反应时做氧化剂,故答案为:
 ;HNO3;
;HNO3;(4)⑤为Cl元素,原子核外有3个电子层,最外层电子数为7,所以在第三周期ⅦA族,电解饱和食盐水的产物为氢氧化钠、氢气和氯气,反应的方程式为
2NaCl+2H2O
| ||
| ||
(5)①甲元素单质在冷的浓硫酸或空气中,表面都生成致密的氧化膜,发生钝化反应,应为铝单质,乙元素原子核外L层电子数是M层电子数的4倍,应为镁元素,故答案为:铝;镁;
②②的最高价氧化物对应的水化物与甲的最高价氧化物的反应为氢氧化钠和氧化铝的反应,氧化铝为两性氧化物,与氢氧化钠反应生成偏铝酸钠和水,反应的化学方程式为
2NaOH+Al2O3=2NaAlO2+H2O,故答案为:2NaOH+Al2O3=2NaAlO2+H2O;
(6)反应的方程式为:N2+3H2═2NH3,1molN2完全反应转化为NH3的反应热为:946kJ+3×436kJ-6×391kJ=-92kJ,所以反应放出热量,故答案为:放出;92.
点评:本题考查较为综合,涉及元素的推断、元素周期律、氧化还原反应、电解以及化学反应与能量等问题,题目难度中等,注意正确把握元素周期律的递变规律以及相关基础之知识的积累.

练习册系列答案
 初中暑期衔接系列答案
初中暑期衔接系列答案
相关题目
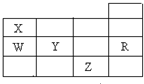 表为元素周期表前四周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中,正确的是( )
表为元素周期表前四周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中,正确的是( )