题目内容
已知五种元素的原子序数的大小顺序为C>A>B>D>E,A、C同周期,B、C同主族.A与B形成离子化合物A2B,A2B中所有离子的电子数相同,其电子总数为30;D和E可形成4核10个电子分子.试回答下列问题:
(1)写出下列元素的元素名称:A
(2)用电子式表示离子化合物A2B的形成过程:
 .
.
(3)写出D元素形成的单质的结构式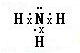
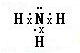 .
.
(4)实验室制取D的氢化物的化学方程式
(5)A、B两元素组成的化合物A2B2属于
(1)写出下列元素的元素名称:A
钠
钠
、C硫
硫
.(2)用电子式表示离子化合物A2B的形成过程:


(3)写出D元素形成的单质的结构式
N≡N
N≡N
;D与E形成的化合物的电子式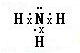
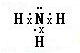
(4)实验室制取D的氢化物的化学方程式
2NH4Cl+Ca(OH)2
CaCl2+2NH3↑+2H2O
| ||
2NH4Cl+Ca(OH)2
CaCl2+2NH3↑+2H2O
.
| ||
(5)A、B两元素组成的化合物A2B2属于
离子
离子
(“离子”或“共价”)化合物,存在的化学键是离子键和共价键
离子键和共价键
.分析:A与B形成离子化合物A2B,A2B中所有粒子的电子数相同,且电子总数为30所以每个离子都有10个电子,由化学式的结构可知,B带2个单位负电荷,A带1个单位正电荷,所以A是Na元素,B是O元素,因为A、C同周期,B与C同主族,所以C为S元素.
根据题意D和E可形成4核10电子的分子,原子序数B>D>E,可知该分子是NH3,所以D是N元素,E是H元素.
根据题意D和E可形成4核10电子的分子,原子序数B>D>E,可知该分子是NH3,所以D是N元素,E是H元素.
解答:解:A与B形成离子化合物A2B,A2B中所有粒子的电子数相同,且电子总数为30所以每个离子都有10个电子,由化学式的结构可知,B带2个单位负电荷,A带1个单位正电荷,所以A是Na元素,B是O元素,因为A、C同周期,B与C同主族,所以C为S元素.
根据题意D和E可形成4核10电子的分子,原子序数B>D>E,可知该分子是NH3,所以D是N元素,E是H元素.
A是Na元素,B是O元素,C为S元素,D是N元素,E是H元素.
(1)A是Na元素,元素名称为钠;C为S元素,元素名称为硫.
故答案为:钠;硫.
(2)A2B是Na2O,由钠离子与氧离子形成的离子化合物,Na2O的形成过程为 .
.
故答案为: .
.
(3)D是N元素,形成的单质为N2,氮原子之间形成3对共用电子对,结构式为N≡N.
故答案为:N≡N.
(4)D是N元素,E是H元素,形成的化合物为NH3,氮原子与氢原子之间形成1对共用电子对,电子式为
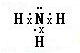 .
.
故答案为: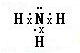 .
.
(4)D是N元素,其氢化物为NH3,实验式制取氨气的方程式为2NH4Cl+Ca(OH)2
CaCl2+2NH3↑+2H2O.
故答案为:2NH4Cl+Ca(OH)2
CaCl2+2NH3↑+2H2O.
(5)A、B两元素组成的化合物A2B2是Na2O2,Na2O2是钠离子与过氧根离子之间通过离子键形成的离子化合物,过氧根离子中氧原子之间为共价键.
故答案为:离子;离子键,共价键.
根据题意D和E可形成4核10电子的分子,原子序数B>D>E,可知该分子是NH3,所以D是N元素,E是H元素.
A是Na元素,B是O元素,C为S元素,D是N元素,E是H元素.
(1)A是Na元素,元素名称为钠;C为S元素,元素名称为硫.
故答案为:钠;硫.
(2)A2B是Na2O,由钠离子与氧离子形成的离子化合物,Na2O的形成过程为
 .
.故答案为:
 .
.(3)D是N元素,形成的单质为N2,氮原子之间形成3对共用电子对,结构式为N≡N.
故答案为:N≡N.
(4)D是N元素,E是H元素,形成的化合物为NH3,氮原子与氢原子之间形成1对共用电子对,电子式为
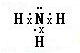 .
.故答案为:
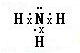 .
.(4)D是N元素,其氢化物为NH3,实验式制取氨气的方程式为2NH4Cl+Ca(OH)2
| ||
故答案为:2NH4Cl+Ca(OH)2
| ||
(5)A、B两元素组成的化合物A2B2是Na2O2,Na2O2是钠离子与过氧根离子之间通过离子键形成的离子化合物,过氧根离子中氧原子之间为共价键.
故答案为:离子;离子键,共价键.
点评:以元素推断为载体,考查电子式、结构式、反应方程式、化学键,难度不大,注意基础知识的掌握.

练习册系列答案
相关题目