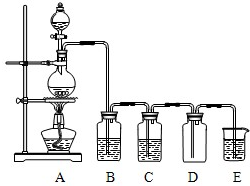
题目内容
8.工业生产高氯酸时,同时生产了一种常见的重要含氯消毒剂和漂白剂亚氯酸钠(NaClO2),其工艺流程如下:
已知:
1.NaHSO4溶解度随温度的升高而增大,适当条件下可结晶析出.
2.高氯酸是至今为止人们已知酸中的最强酸,沸点90℃.
请回答下列问题
(1)反应器Ⅰ中发生反应的化学方程式为3NaClO3+3H2SO4=HClO4+2ClO2↑+3NaHSO4+H2O,冷却的目的是降低NaHSO4的溶解度,使NaHSO4结晶析出,能用蒸馏法分离出高氯酸的原因是高氯酸的沸点低.
(2)反应器Ⅱ中发生反应的离子方程式为2ClO2+SO2+4OH-═2ClO2-+SO42-+2H2O.
(3)通入反应器Ⅱ中的SO2 用另一物质H2O2 代替同样能生成NaClO2,请简要说明双氧水在反应中能代替SO2 的原因是H2O2有还原性也能把ClO2还原为NaClO2
(4)请写出工业上用氯气和NaOH溶液生产另一种消毒剂NaClO的离子方程式Cl2+2OH-=ClO-+Cl-+H2O.
分析 NaClO3和浓H2SO4在反应器I中反应生成HClO4、ClO2和NaHSO4,ClO2在反应器II中与二氧化硫、氢氧化钠反应生成亚氯酸钠,再得到其晶体;反应器I中得到的溶液通过冷却过滤得到NaHSO4晶体,滤液为HClO4,蒸馏得到纯净的HClO4;
(1)NaClO3和浓H2SO4在反应器I中反应生成HClO4、ClO2和NaHSO4;冷却溶液时会析出NaHSO4晶体;高氯酸易挥发,蒸馏可以得到高氯酸;
(2)反应器Ⅱ中ClO2与二氧化硫、氢氧化钠反应生成亚氯酸钠;
(3)H2O2具有还原性,能还原ClO2;
(4)具有强氧化性的物质能用作消毒剂和漂白剂;氯气和NaOH溶液生成NaCl和次氯酸钠、水.
解答 解:NaClO3和浓H2SO4在反应器I中反应生成HClO4、ClO2和NaHSO4,ClO2在反应器II中与二氧化硫、氢氧化钠反应生成亚氯酸钠,再得到其晶体;反应器I中得到的溶液通过冷却过滤得到NaHSO4晶体,滤液为HClO4,蒸馏得到纯净的HClO4;
(1)NaClO3和浓H2SO4在反应器I中反应生成HClO4、ClO2和NaHSO4,其反应的化学方程式为:3NaClO3+3H2SO4=HClO4+2ClO2↑+3NaHSO4+H2O;冷却溶液时会降低NaHSO4的溶解度,使NaHSO4结晶析出;高氯酸的沸点低,易挥发,蒸馏可以得到纯净的高氯酸;
故答案为:3NaClO3+3H2SO4=HClO4+2ClO2↑+3NaHSO4+H2O;降低NaHSO4的溶解度,使NaHSO4结晶析出;高氯酸的沸点低;
(2)反应器Ⅱ中ClO2与二氧化硫、氢氧化钠反应生成亚氯酸钠,其反应的离子方程式为:2ClO2+SO2+4OH-═2ClO2-+SO42-+2H2O;
故答案为:2ClO2+SO2+4OH-═2ClO2-+SO42-+2H2O;
(3)H2O2中O元素为-1价,有还原性,能被强氧化剂氧化,H2O2能还原ClO2,所以入反应器Ⅱ中的SO2用H2O2代替同样能生成NaClO2;
故答案为:H2O2有还原性也能把ClO2还原为NaClO2;
(4)工业上用氯气和NaOH溶液生产次氯酸钠溶液,同时生成NaCl和水,其反应的离子方程式为:Cl2+2OH-=ClO-+Cl-+H2O;
故答案为:Cl2+2OH-=ClO-+Cl-+H2O.
点评 本题以亚氯酸钠制备为背景,考查了学生阅读题目获取信息的能力、对氧化还原反应相关知识的运用、有关实验操作和简单实验设计能力,以及在新情境下综合运用知识解决问题的能力,题目有一定的难度.

| A. | NF3的摩尔质量为71g | |
| B. | 还原剂和氧化剂的物质的量之比是2:1 | |
| C. | 若生成0.2mol HNO3,则转移0.2mol电子 | |
| D. | NF3在潮湿的空气中泄漏可观察到红棕色气体 |
| A. | S(g)+O2(g)═SO2(g)△H=a;S(s)+O2(g)═SO2(g)△H=b;则a>b | |
| B. | C(石墨,s)═C(金刚石,s)△H=+1.9 kJ/mol,则可判定石墨比金刚石稳定 | |
| C. | NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l)△H=-57.4 kJ/mol,则含20 g NaOH的溶液与稀盐酸完全反应,放出的热量为28.7 kJ | |
| D. | CaCO3(s)═CaO(s)+CO2(g)△H>0,则该反应任何温度下都能自发进行 |
| A. | 常温常压下,氧原子总数为0.2NA的SO2和O2的混合气体,其体积为2.24 L | |
| B. | 0.1mol•L-1的NaHSO4溶液中含有Na+的物质的量为0.1mol | |
| C. | 7.8 gNa2S和7.8 gNa2O2中含有的阴离子数目均为0.1 NA | |
| D. | 标准状况下,22.4 L盐酸含有NA个HCl分子 |
| A. | 一氟一氯甲烷只有一种结构,可以证明甲烷是正四面体结构 | |
| B. | 构成乙烯分子的所有原子都在同一平面内,其分子中只含有极性键 | |
| C. | 邻二甲苯没有同分异构体表明苯的凯库勒结构式存在局限,不准确 | |
| D. | 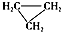 和CH3-CH═CH2互为同分异构体 和CH3-CH═CH2互为同分异构体 |
| A. | 山梨酸易溶于四氯化碳 | |
| B. | 山梨酸能与氢气发生加成反应 | |
| C. | 山梨酸能和乙醇反应生成酯 | |
| D. | 1mol山梨酸能和金属钠反应生成1mol氢气 |
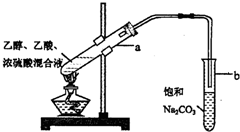
 CH3COOC2H5+H2O.
CH3COOC2H5+H2O. 、C:CH3COOH
、C:CH3COOH