题目内容
18.某小组准备在实验室中制取干燥、纯净的氯气并验证氯气的性质.步骤1.制取纯净的氯气(装置如下图)
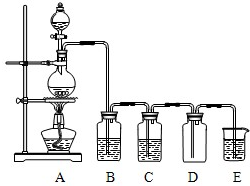
(1)写出A中反应的化学方程式:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O
(2)B中加入的物质是:饱和食盐水,C中加入的物质是:浓硫酸.
(3)E中加入的物质是:NaOH溶液,反应的化学方程式为2NaOH+Cl2 =NaCl+NaClO+H2O.
( 4 )若A中有14.6g HCl 被氧化,产生氯气的物质的量为0.2mol.
步骤2.验证氯气的性质:
实验室为方便得到氯气常用高锰酸钾与浓盐酸反应,方程式如下:
2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O
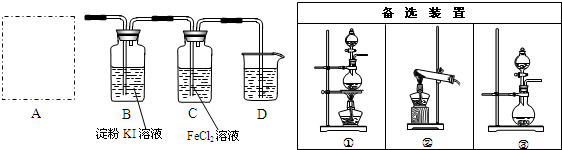
(5)A部分应选择的装置③ (填序号),B中观察到溶液变蓝色现象表明KI被氧化.
(6)用KSCN溶液试剂检验FeCl2已被氧化,写出FeCl2被氧化的反应方程式:2FeCl2+Cl2=2FeCl3.
分析 (1)浓盐酸和二氧化锰在加热条件下发生氧化还原反应生成氯化锰、氯气和水;
(2)浓盐酸有挥发性,制备的氯气中混有氯化氢和水蒸气,食盐水溶液中的氯离子抑制氯气的溶解,降低氯气的溶解度,用饱和的食盐水除去HCl气体,用浓硫酸干燥氯气;
(3)装置E进行尾气处理,用氢氧化钠溶液吸收,反应生成氯化钠、次氯酸钠与水;
(4)被氧化的HCl生成氯气,根据Cl原子守恒计算生成氯气物质的量;
(5)该反应为固体与液态不需要加热制备气体;氯气氧化碘离子为碘单质,碘遇淀粉变蓝色;
(6)FeCl2被氯气氧化生成FeCl3,用KSCN溶液检验溶液含有铁离子.
解答 解:(1)浓盐酸和二氧化锰在加热条件下发生氧化还原反应生成氯化锰、氯气和水,反应方程式为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,
故答案为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;
(2)浓盐酸有挥发性,浓盐酸中的水在加热条件下变成水蒸气,所以氯气中混有氯化氢和水蒸气,氯化氢极易溶于水,氯气能溶于水,且与水反应:Cl2+H2O=H++Cl-+HClO,食盐水溶液中的氯离子抑制氯气的溶解,降低氯气的溶解度,装置B可用饱和的食盐水除去HCl气体,装置C用浓硫酸干燥氯气;
故答案为:饱和食盐水;浓硫酸;
(3)氯气有毒,污染环境,所以不能直接排空,装置E进行尾气处理,用氢氧化钠溶液吸收,反应生成氯化钠、次氯酸钠与水,反应方程式为:2NaOH+Cl2 =NaCl+NaClO+H2O,
故答案为:NaOH溶液;2NaOH+Cl2 =NaCl+NaClO+H2O;
(4)被氧化HCl的物质的量为$\frac{14.6g}{36.5g/mol}$=0.4mol,被氧化的HCl生成氯气,根据Cl原子守恒,生成氯气物质的量为$\frac{0.4mol}{2}$=0.2mol,
故答案为:0.2;
(5)该反应为固体与液态不需要加热制备气体,故选择装置③;发生反应:Cl2+2KI=2KCl+I2,碘遇淀粉变蓝色,B中观察到溶液变蓝色现象表明KI被氧化.
故答案为:③;溶液变蓝色;
(6)FeCl2被氯气氧化生成FeCl3,反应方程式为:2FeCl2+Cl2=2FeCl3,用KSCN溶液检验,溶液变为红色,说明FeCl2已被氧化,
故答案为:KSCN溶液;2FeCl2+Cl2=2FeCl3.
点评 本题考查氯气的实验室制备与性质实验,侧重对基础知识的巩固,比较基础.

 轻松暑假总复习系列答案
轻松暑假总复习系列答案| A. | 混合物中Fe的物质的量为0.03mol | |
| B. | 混合物中Fe3O4的物质的量为0.01mol | |
| C. | 反应中产生的气体在标准状况下的体积为448mL | |
| D. | 若用足量的CO在高温下与相同质量的上述固体混合物反应,最终能得到7.2g铁 |
| A. | 花生油属于纯净物,柴油属于混合物 | |
| B. | 花生油属于酯类,柴油属于烃类 | |
| C. | 花生油属于有机物,柴油属于无机物 | |
| D. | 花生油属于高分子化合物,柴油属于小分子化合物 |
| A. | 制氯乙烷:CH2=CH2+HCl$→_{△}^{催化剂}$ CH3CH2Cl | |
| B. | 制甲基丙烯酸甲酯:CH3C≡CH+CO+CH3OH$\stackrel{Pd}{→}$CH2=C(CH3)COOCH3 | |
| C. | 制CuSO4:2Cu+O2$\frac{\underline{\;\;△\;\;}}{\;}$2CuO,CuO+H2SO4(稀)═CuSO4+H2O | |
| D. | 制Cu(NO3)2:Cu+4HNO3(浓)═Cu(NO3)2+2NO2↑+2H2O |
| A. | SO2和O2不再化合,反应停止了 | |
| B. | 容器内压强保持不变 | |
| C. | SO2、O2和 SO3的浓度相等 | |
| D. | SO2、O2和 SO3的物质的量之比为2:1:2 |
| A. | 标准状况下,22.4 L己烷中的分子数约为NA个 | |
| B. | 常温常压下,在18 g H218O中含有NA个水分子 | |
| C. | 标准状况下,15 g CH3CH3所含共价键数为3.5NA个 | |
| D. | 电解精炼铜时,若电路中转移的电子数为2NA个,则阳极质量减轻64 g |




