题目内容
【题目】元素①~⑧在元素周期表中的位置如下,回答有关问题:

(1)表中能形成两性氢氧化物的元素是(填元素符号)______,最不活泼的元素的原子结构示意图为________。
(2)③号元素和⑧号元素的气态氢化物中,热稳定性较强的是(填化学式)________
(3)④号元素和⑥号元素的离子半径较大的是(填离子符号)_______
(4)上述元素中,金属性最强的元素与非金属最强的元素形成化合物的化学式______
(5)②的氢化物发生催化氧化的化学方程式为___________。
(6)写出⑤号元素的最高价氧化物对应的水化物和⑧号元素的最高价氧化物对应的水化物发生反应的离子方程式_______
【答案】Al  H2O F- NaF 4NH3+5O2
H2O F- NaF 4NH3+5O2![]() 4NO +6H2O H+ + OH- = H2O
4NO +6H2O H+ + OH- = H2O
【解析】
由元素在周期表中的位置可知,①为H、②为N、③为O、④为F、⑤为Na、⑥为Al、⑦为Si、⑧为S、⑨为Ar。结合元素周期律和元素及其化合物的性质分析解答。
由元素在周期表中的位置可知,①为H、②为N、③为O、④为F、⑤为Na、⑥为Al、⑦为Si、⑧为S、⑨为Ar。
(1)氢氧化铝属于两性氢氧化物,对应的元素为Al;稀有气体原子最外层为稳定结构,性质最不活泼,因此Ar的化学性质最不活泼,原子结构示意图为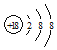 ,故答案为:Al;
,故答案为:Al;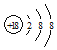 ;
;
(2)元素的非金属性越强,形成的氢化物越稳定,非金属性:O>S,故③号元素和⑧号元素的气态氢化物中,热稳定性较强的是H2O,故答案为:H2O;
(3)电子层数相同的微粒,核电荷数越大,半径越小,④号元素和⑥号元素都是2个电子层,因此离子半径较大的是F-,故答案为:F-;
(4)上述元素中,金属性最强的元素为钠,非金属最强的元素为氟,二者形成化合物的化学式为NaF,故答案为:NaF;
(5)元素②的氢化物为氨气,氨气催化氧化的化学方程式为4NH3+5O2![]() 4NO+6H2O,故答案为:4NH3+5O2
4NO+6H2O,故答案为:4NH3+5O2![]() 4NO+6H2O;
4NO+6H2O;
(6)元素⑤的最高价氧化物对应的水化物为氢氧化钠,属于强碱,⑧号元素的最高价氧化物对应的水化物为硫酸,属于强酸,二者反应的离子方程式为H+ + OH- = H2O,故答案为:H+ + OH- = H2O。

【题目】如图所示装置中,观察到电流计指针偏转,M棒变粗,N棒变细,由此判断表中所列M、N、P物质,其中可以成立的是

选项 | M | N | P |
A | 锌 | 铜 | 稀硫酸 |
B | 铜 | 铁 | 稀盐酸 |
C | 银 | 锌 | 硝酸银溶液 |
D | 锌 | 铁 | 硝酸铁溶液 |
A. AB. BC. CD. D