题目内容
【题目】标准状况下V L氨气溶解在1 L水中(水的密度近似为1 g·mL-1),所得溶液的密度为ρ g·mL-1,质量分数为w,物质的量浓度为c mol·L-1,则下列关系中不正确的是
A. ρ=![]() B. w=
B. w=![]()
C. w=![]() D. c=
D. c=![]()
【答案】A
【解析】试题分析:A、VL氨气的物质的量为![]() mol,氨气质量为
mol,氨气质量为![]() mol×17g/mol=
mol×17g/mol=![]() g,1L水的质量为1000mL×1g/mL=1000g,故溶液质量为(
g,1L水的质量为1000mL×1g/mL=1000g,故溶液质量为(![]() +1000)g,溶液体积为
+1000)g,溶液体积为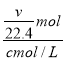 =
=![]() L,所以溶液的密度为
L,所以溶液的密度为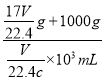 =
=![]() g/mL,A错误;B、根据c=
g/mL,A错误;B、根据c=![]() 可知,该氨水质量分数w=
可知,该氨水质量分数w=![]() ,B正确;C、溶液的质量分数w=
,B正确;C、溶液的质量分数w=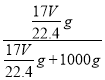 ×100%=
×100%=![]() ×100%,C正确;D、溶液体积为
×100%,C正确;D、溶液体积为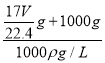 =
=![]() L,氨气的物质的量浓度c=
L,氨气的物质的量浓度c= =
=![]() mol/L,D正确。
mol/L,D正确。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目