题目内容
1.已知在酸性条件下有以下反应关系KBrO3 能将KI氧化成I2 或KIO3,其本身被还原为Br2,Br2 能将I-氧化为I2;KIO3 能将 I- 氧化为I2,也能将Br-氧化成Br2,其本身被还原为I2.现向含有1mol KI的硫酸溶液中加入含a mol KBrO3的溶液,a的取值不同,所得产物也不同.(1)试将讨论的结果填入表中:
| 编 号 | а取值范围 | 产物化学式(离子符号) |
| ① | I2、Br- | |
| ② | $\frac{1}{6}$<а<1/5 | |
| ③ | I2、IO3-、Br2 | |
| ④ |
分析 (1)根据题干信息可知,发生反应的方程式有:KBrO3+6KI+3H2SO4═3I2+KBr+3K2SO4+3H2O、2KBrO3+10KI+6H2SO4═5I2+Br2+6K2SO4+6H2O、6KBrO3+5KI+3H2SO4═5KIO3+3Br2+3K2SO4+3H2O,根据反应方程式确定a的范围及产物;
(2)碘单质和碘酸钾的物质的量相等,碘单质和碘酸钾的物质的量为:$\frac{1mol}{3}$=$\frac{1}{3}$mol,然后根据反应10KI+2KBrO3+6H2SO4=5I2+Br2+6K2SO4+6H2O和5KI+6KBrO3+3H2SO4=5KIO3+3Br2+3K2SO4+3H2O计算a值.
解答 解:(1)根据题干信息可知,发生反应的方程式有:KBrO3+6KI+3H2SO4═3I2+KBr+3K2SO4+3H2O、2KBrO3+10KI+6H2SO4═5I2+Br2+6K2SO4+6H2O、6KBrO3+5KI+3H2SO4═5KIO3+3Br2+3K2SO4+3H2O,
①当a≤$\frac{1}{6}$时,KBrO3不足,反应生成I2、Br-,反应方程式为:6KI+KBrO3+3H2SO4=3I2+KBr+3K2SO4+3H2O,则产物为:I2、Br-;
②当 $\frac{1}{6}$<a<$\frac{1}{5}$时发生反应:KBrO3+6KI+3H2SO4═3I2+KBr+3K2SO4+3H2O、2KBrO3+10KI+6H2SO4═5I2+Br2+6K2SO4+6H2O,反应产物为:I2、Br-、Br2;发生的反应具有A又有B的反应;
④当a≥$\frac{5}{6}$时,KBrO3足量,发生反应为:5KI+6KBrO3+3H2SO4=5KIO3+3Br2+3K2SO4+3H2O,所以反应产物为:IO3-、Br2;
③当 $\frac{1}{5}$<a<$\frac{5}{6}$时,反应按照反应2KBrO3+10KI+6H2SO4═5I2+Br2+6K2SO4+6H2O、6KBrO3+5KI+3H2SO4═5KIO3+3Br2+3K2SO4+3H2O进行,反应产物为:I2、IO3-、Br2,
故答案为:
| 编 号 | а 的取值范围 | 产物的化学式(离子符号) |
| ① | a≤1/6 | I2、Br- |
| ② | 1/6<а<1/5 | I2、Br-、Br2 |
| ③ | 1/5<а<6/5 | I2、IO3-、Br2 |
| ④ | A≥6/5 | IO3-、Br2 |
(2)若产物中碘单质和碘酸钾的物质的量相等,总共含有1mol碘化钾,根据碘原子守恒可知,碘单质和碘酸钾的物质的量为:$\frac{1mol}{3}$=$\frac{1}{3}$mol,
由反应10KI+2KBrO3+6H2SO4=5I2+Br2+6K2SO4+6H2O和5KI+6KBrO3+3H2SO4=5KIO3+3Br2+3K2SO4+3H2O可知,反应消耗KBrO3的物质的量为:n(KBrO3)=$\frac{1}{3}$mol×$\frac{2}{5}$+$\frac{1}{3}$mol×$\frac{6}{5}$=$\frac{8}{15}$mol,
故答案为:$\frac{8}{15}$.
点评 本题考查了有关范围讨论的化学计算,题目难度较大,根据题干信息正确判断各物质的氧化性强弱为较大关键,要求学生能够根据氧化性强弱正确书写发生反应的化学方程式.

| A. | 一滴香: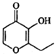 | B. | 芬必得: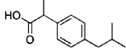 | ||
| C. | 维生素B5: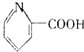 | D. | 扑热息痛: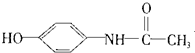 |
| A. | 电解时电解池的阳极一定是阴离子放电 | |
| B. | 反应NH3(g)+HCl(g)═NH4Cl(s)在室温下可自发进行:则该反应的△H>0 | |
| C. | 其他条件不变,增大压强,平衡可能移动,但平衡常数一定不变 | |
| D. | 铁制品表面镶锌块和铁制品表面镀锡,都能起到防腐的作用且防腐原理是相同的 |
| A. | FeCl3 | B. | FeCl2 | C. | Fe(OH)3 | D. | Fe3O4 |
| A. | 加少量NaCl固体 | B. | 加少量NaOH | C. | 加少量CuSO4固体 | D. | 加少量Na2S固体 |

(1)①铜帽溶解时加入H2O2的目的是Cu+H2O2+H2SO4=CuSO4+2H2O(用化学方程式表示).②铜帽溶解完全后,需将溶液中过量的H2O2除去.除去H2O2的简便方法是加热至沸.
(2)为确定加入锌灰(主要成分为Zn、ZnO,杂质为铁及其氧化物)的量,实验中需测定除去H2O2后溶液中Cu2+的含量.实验操作为:准确量取一定体积的含有Cu2+的溶液于带塞锥形瓶中,加适量水稀释,调节溶液pH=3~4,加入过量的KI,用Na2S2O3标准溶液滴定至终点.上述过程中反应的离子方程式如下:
2Cu2++4I-═2CuI(白色)↓+I2
2S2O${\;}_{3}^{2-}$+I2═2I-+S4O${\;}_{6}^{2-}$
①滴定选用的指示剂为淀粉溶液,滴定终点观察到的现象为蓝色褪去.
②若滴定前溶液中的H2O2没有除尽,所测定的Cu2+含量将会偏高(填“偏高”“偏低”或“不变”).
(3)已知pH>11时Zn(OH)2能溶于NaOH溶液生成[Zn(OH)4]2-.下表列出了几种离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mol•L-1计算).
| 开始沉淀的pH | 沉淀完全的pH | |
| Fe3+ | 1.1 | 3.2 |
| Fe2+ | 5.8 | 8.8 |
| Zn2+ | 5.9 | 8.9 |
由除去铜的滤液制备ZnO的实验步骤依次为:①向滤液中加入30%H2O2,使其充分反应;②滴加1.0mol•L-1NaOH,调节溶液PH约为5(或3.2≤pH<5.9),使Fe3+沉淀完全;
③过滤;④向滤液中滴加1.0mol•L-1NaOH,调节溶液PH约为10(或8.9≤pH≤11),使Zn2+沉淀完全;⑤过滤、洗涤、干燥;⑥900℃煅烧.
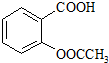 )是世界上应用最广泛的解热、镇痛和抗炎药.乙酰水杨酸受热易分解,分解温度为128~135℃.某学习小组在实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成阿司匹林,制备基本操作流程如下:
)是世界上应用最广泛的解热、镇痛和抗炎药.乙酰水杨酸受热易分解,分解温度为128~135℃.某学习小组在实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成阿司匹林,制备基本操作流程如下: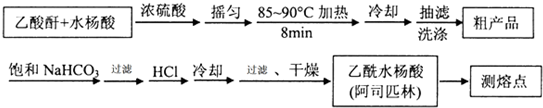
主要试剂和产品的物理常数
| 名称 | 相对分子质量 | 熔点或沸点(℃) | 水 |
| 水杨酸 | 138 | 158(熔点) | 微溶 |
| 醋酸 | 102 | 139.4(沸点) | 反应 |
| 乙酸水杨酸 | 180 | 135(熔点) | 微溶 |
(1)制备阿司匹林时,要使用干燥的仪器的原因是防止乙酸酐水解.
(2)写出制备阿司匹林的化学方程式
 .
.(3)①合成阿斯匹林时,最合适的加热方法是水浴加热.
②过滤所得粗产品要用少量冰水洗涤,则洗涤的具体操作是关闭水龙头,向漏斗中加冰水至浸没沉淀物,使洗涤剂缓慢通过沉淀物,重复上述操作2-3次.
(4)提纯粗产物中加入饱和NaHCO3溶液至没有CO2产生为止,再过滤,则加饱和NaHCO3溶液的目的是使乙酰水杨酸与NaHCO3溶液作用转化为易溶于水的乙酰水杨酸钠,与不溶性杂质分离.另一种改进的提纯方法,称为重结晶提纯法.方法如下:
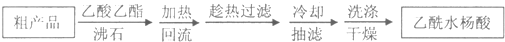
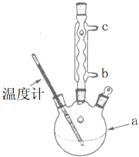
(5)改进的提纯方法中加热同流的装置如下图所示,使用温度计的目的是控制反应温度,防止温度过高,乙酰水杨酸受热分解.冷凝水的流进方向是b.(填“b”或“c”).
(6)检验产品中是否含有水杨酸的试剂是氯化铁溶液.
(7)该学习小组在实验中原料用量:2.0g水杨酸、5.0mL醋酸酐(ρ=1.08g/cm3),最终称得产品m=2.2g,则所得乙酰水杨酸的产率为84.3%.