题目内容
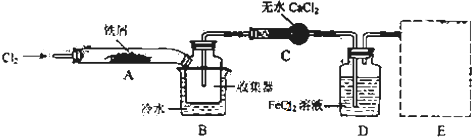
15.工业上可用焦炭与二氧化硅的混合物在高温下与氯气反应生成SiCl4和CO,SiCl4经提纯后用氢气还原得高纯硅.以下是实验室制备SiCl4的装置示意图.
已知:SiCl4熔点为-70.0℃,沸点为57.7℃,且遇水易水解.
(1)装置C中的试剂是浓硫酸:装置F的作用为防止F右端的水蒸气进入E与四氯化硅反应,造成产物不纯.
(2)装置A中发生反应的离子方程式为:MnO2+4H++2Cl- $\frac{\underline{\;\;△\;\;}}{\;}$Mn2++2H2O+Cl2↑.A装置中,有一处明显错误是无石棉网.
(3)装置D的硬质玻璃管中发生反应的化学方程式是SiO2+2C+2Cl2$\frac{\underline{\;\;△\;\;}}{\;}$SiCl4+2CO.
(4)G中吸收气体一段时间后,吸收液中肯定存在OH-、Cl-和SO42-.为探究该吸收液中可能存在的其它酸根离子(忽略空气中CO2的影响).
【提出假设】假设1:只有SO32-;假设2:既无SO32-也无ClO-:假设3:只有ClO-.
【设计方案,进行实验】可供选择的实验试剂有:3mol/L H2SO4溶液、1mol/L NaOH溶液、溴水、品红溶液、0.01mol/L KMnO4溶液、淀粉-KI溶液.
各取少量吸收液于a、b、c三支试管中,分别滴加适量的3mol/LH2SO4溶液后,进行下列实验.请完成下表:
| 序号 | 操作 | 可能出现的现象 | 结论 |
| ① | 向a试管中滴加几滴0.01mol/L的KMnO4(或溴水)溶液 | 若溶液褪色 | 则假设1成立 |
| 若溶液不褪色 | 则假设2或3成立 | ||
| ② | 向b试管中滴加几滴品红溶液 | 若溶液褪色 | 则假设1或3成立 |
| 若溶液不褪色 | 假设2成立 | ||
| ③ | 向C试管中滴加几滴淀粉-KI溶液 | 若溶液变为蓝色 | 假设3成立 |
分析 制备四氯化硅的实验流程:A中发生二氧化锰与浓盐酸的反应生成氯气,MnO2+4H++2Cl- $\frac{\underline{\;\;△\;\;}}{\;}$Mn2++2H2O+Cl2↑,B中饱和实验水除去HCl,C装置中浓硫酸干燥氯气,D中发生Si与氯气的反应生成四氯化硅,由信息可知,四氯化硅的沸点低,则E装置冷却可收集四氯化硅,F可防止防止F右端的水蒸气进入E与四氯化硅反应,造成产物不纯,最后G处理含氯气的尾气.
(1)装置C中的试剂应该吸收水而不能吸收氯气,用浓硫酸干燥氯气;四氯化硅遇水极易水解,F可防止空气中的水进入;
(2)二氧化锰和浓盐酸发生氧化还原反应生成氯化锰、氯气和水;A装置中,有一处明显错误是圆底烧瓶加热缺少石棉网;
(3)在D装置中二氧化硅和碳和氯气反应生成四氯化硅和一氧化碳;
(4)由假设1和假设2可知,要检测的为SO32-和ClO-,故假设3为只有ClO-,又因为SO32-会使KMnO4溶液(或溴水)褪色,而ClO-不会,所故可以用来检测假设1,H2SO3和ClO-具有漂白性,会使品红溶液褪色,所以可以用来检测假设2,ClO-可以氧化KI反应生成碘单质,遇到淀粉边蓝色,可以用来检测假设3.
解答 解:(1)浓盐酸具有挥发性,加热促进挥发,导致制取的氯气中含有氯化氢,为除去氯化氢,装置B中的试剂应该吸收氯化氢而不能吸收氯气,为饱和食盐水,装置C用浓硫酸吸水,四氯化硅遇水极易水解,F可防止右端的水蒸气进入E与四氯化硅反应,造成产物不纯,
故答案为:浓硫酸;防止F右端的水蒸气进入E与四氯化硅反应,造成产物不纯;
(2)装置A是氯气发生装置,A中二氧化锰与浓盐酸在加热条件下反应生成氯化锰、氯气和水,其离子方程式为MnO2+4H++2Cl- $\frac{\underline{\;\;△\;\;}}{\;}$Mn2++2H2O+Cl2↑,圆底烧瓶底部表面积比较大,需用石棉网确保底部受热均匀,所以A装置中,有一处明显错误是圆底烧瓶加热缺少石棉网,
故答案为:MnO2+4H++2Cl- $\frac{\underline{\;\;△\;\;}}{\;}$Mn2++2H2O+Cl2↑;无石棉网;
(3)在D装置中二氧化硅和碳和氯气反应生成四氯化硅和一氧化碳,反应为:SiO2+2C+2Cl2$\frac{\underline{\;\;△\;\;}}{\;}$SiCl4+2CO,
故答案为:SiO2+2C+2Cl2$\frac{\underline{\;\;△\;\;}}{\;}$SiCl4+2CO;
(4)由假设1和假设2可知,要检测的为SO32-和ClO-,故假设3为只有ClO-,又因为SO32-会使KMnO4溶液褪色,而ClO-不会,所故可以用来检测假设1,H2SO3和ClO-具有漂白性,会使品红溶液褪色,所以可以用来检测假设2,ClO-可以氧化KI反应生成碘单质,遇到淀粉边蓝色,可以用来检测假设3,
故答案为:①0.01mol/L的KMnO4(或溴水);②品红;③淀粉-KI;若溶液变为蓝色.
点评 本题考查制备实验方案的设计,综合了氯气的制法、硅的提纯等实验知识,注意把握制备原理及实验流程中的反应、物质的性质等为解答的关键,侧重分析与实验能力的综合考查,题目难度中等.

 全优考典单元检测卷及归类总复习系列答案
全优考典单元检测卷及归类总复习系列答案 品学双优卷系列答案
品学双优卷系列答案 小学期末冲刺100分系列答案
小学期末冲刺100分系列答案| A. | 加少量NaCl固体 | B. | 加少量NaOH | C. | 加少量CuSO4固体 | D. | 加少量Na2S固体 |
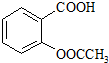 )是世界上应用最广泛的解热、镇痛和抗炎药.乙酰水杨酸受热易分解,分解温度为128~135℃.某学习小组在实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成阿司匹林,制备基本操作流程如下:
)是世界上应用最广泛的解热、镇痛和抗炎药.乙酰水杨酸受热易分解,分解温度为128~135℃.某学习小组在实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成阿司匹林,制备基本操作流程如下: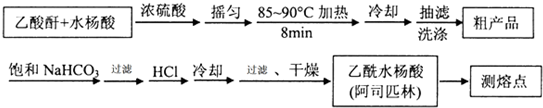
主要试剂和产品的物理常数
| 名称 | 相对分子质量 | 熔点或沸点(℃) | 水 |
| 水杨酸 | 138 | 158(熔点) | 微溶 |
| 醋酸 | 102 | 139.4(沸点) | 反应 |
| 乙酸水杨酸 | 180 | 135(熔点) | 微溶 |
(1)制备阿司匹林时,要使用干燥的仪器的原因是防止乙酸酐水解.
(2)写出制备阿司匹林的化学方程式
 .
.(3)①合成阿斯匹林时,最合适的加热方法是水浴加热.
②过滤所得粗产品要用少量冰水洗涤,则洗涤的具体操作是关闭水龙头,向漏斗中加冰水至浸没沉淀物,使洗涤剂缓慢通过沉淀物,重复上述操作2-3次.
(4)提纯粗产物中加入饱和NaHCO3溶液至没有CO2产生为止,再过滤,则加饱和NaHCO3溶液的目的是使乙酰水杨酸与NaHCO3溶液作用转化为易溶于水的乙酰水杨酸钠,与不溶性杂质分离.另一种改进的提纯方法,称为重结晶提纯法.方法如下:
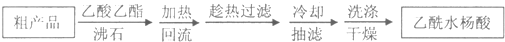
(5)改进的提纯方法中加热同流的装置如下图所示,使用温度计的目的是控制反应温度,防止温度过高,乙酰水杨酸受热分解.冷凝水的流进方向是b.(填“b”或“c”).
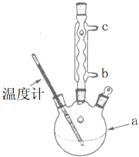
(6)检验产品中是否含有水杨酸的试剂是氯化铁溶液.
(7)该学习小组在实验中原料用量:2.0g水杨酸、5.0mL醋酸酐(ρ=1.08g/cm3),最终称得产品m=2.2g,则所得乙酰水杨酸的产率为84.3%.
| A. | 1.9×-33 | B. | 2.0×10-11 | C. | 8.0×10-33 | D. | 2.5×10-5 |
| A. | HF的电离平衡正向移动,c(H+)增大 | |
| B. | HF的电离程度增大,c(H+)、c(F-)增大、c(HF)减小,则$\frac{c({H}^{+})c({F}^{-})}{c(HF)}$增大 | |
| C. | 稀释过程中,c(OH-)、$\frac{c({H}^{+})}{c(HF)}$均增大 | |
| D. | 溶液的KW、$\frac{c({F}^{-})}{c({H}^{+})}$、pH均不变 |
| A. | 乙醛的结构简式为CH3COH | B. | 乙烷的结构简式为:CH3CH3 | ||
| C. | 羟基的电子式为[:O:H]- | D. | 氯离子的结构示意图为: |