题目内容
4.表是元素周期表的一部分,针对表中的①~⑨种元素,填写下列空白:| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ |
(2)在最高价氧化物的水化物中,酸性最强的化合物的分子式是HClO4,碱性最强的化合物的电子式是:
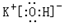 .
.(3)①~⑨中元素M的最高价氧化物的水化物是两性氢氧化物.则元素M在周期表中的位置是第3周期第ⅢA族(填写具体的周期数和族序数);写出M的氧化物与氢氧化钠溶液反应的化学方程式Al2O3+2NaOH=2NaAlO2+H2O.
(4)用电子式表示元素④与⑥的简单化合物的形成过程:
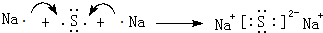 ,该化合物属于离子(填“共价”或“离子”)化合物.
,该化合物属于离子(填“共价”或“离子”)化合物.(5)由元素②形成的单质的电子式是:
 ,该物质是由非极性键(填“极性”或“非极性”)键形成的.
,该物质是由非极性键(填“极性”或“非极性”)键形成的.
分析 由元素在周期表中的物质,可知①是C,②是N,③是O,④是Na,⑤是Al,⑥是S,⑦是Cl,⑧是Ar,⑨是K.
(1)化学性质最稳定的是稀有气体;
(2)在最高价氧化物的水化物中,酸性最强是高氯酸,碱性最强的化合物是KOH;
(3)M的最高价氧化物的水化物是两性氢氧化物,则M为Al,氧化铝与氢氧化钠反应生成偏铝酸钠与水;
(4)元素④与⑥形成的化合物为Na2S,由钠离子与硫离子构成,用Na原子、S原子电子式表示其形成;
(5)由元素②形成的单质为N2,分子中N原子之间形成3对共用电子对;同种元素原子之间形成的共价键,属于非极性键.
解答 解:由元素在周期表中的物质,可知①是C,②是N,③是O,④是Na,⑤是Al,⑥是S,⑦是Cl,⑧是Ar,⑨是K.
(1)稀有气体Ar原子最外层为稳定结构,化学性质最不活泼,故答案为:Ar;
(2)在最高价氧化物的水化物中,酸性最强是HClO4,碱性最强的化合物是KOH,电子式为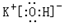 ,
,
故答案为:HClO4;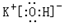 ;
;
(3)M的最高价氧化物的水化物是两性氢氧化物,则M为Al,处于周期表中第3周期第ⅢA族,氧化铝与氢氧化钠反应生成偏铝酸钠与水,反应方程式为:Al2O3+2NaOH=2NaAlO2+H2O,
故答案为:第3周期第ⅢA族;Al2O3+2NaOH=2NaAlO2+H2O;
(4)元素④与⑥形成的化合物为Na2S,属于离子化合物,由钠离子与硫离子构成,用Na原子、S原子电子式表示其形成为: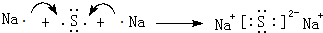 ,
,
故答案为: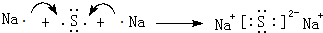 ,离子;
,离子;
(5)由元素②形成的单质为N2,分子中N原子之间形成3对共用电子对,电子式为 ;由同种元素原子之间形成的共价键,属于非极性键,
;由同种元素原子之间形成的共价键,属于非极性键,
故答案为: ;非极性键.
;非极性键.
点评 本题考查元素周期律与元素周期表综合应用,题目难度不大,注意理解掌握用电子式表示物质或化学键的形成.

| A. | 氯水 | B. | 液氯 | C. | 漂白粉 | D. | 氯化镁 |
| A. | FeCl2 | B. | Fe(OH)3 | C. | NaOH | D. | H2SiO3 |
| A. | 氧化亚铁加入稀硝酸:FeO+2H+=Fe2++H2O | |
| B. | 硅酸钠水溶液中通入足量的二氧化碳:SiO32-+CO2+2H2O=H2SiO3(胶体)+CO32- | |
| C. | 碳酸氢铵溶液和足量氢氧化钠溶液混合:HCO3-+OH-=CO32-+H2O | |
| D. | 铝片加入烧碱溶液:2Al+2OH-+2H2O=2AlO2-+3H2↑ |
| A. | 3478Se和3480Se 分别含有44和46个质子 | |
| B. | 3478Se和3480Se互为同位素 | |
| C. | 3478Se 和3480Se互为同素异形体 | |
| D. | 3478Se和3480Se都含有34个中子 |
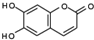 已知
已知 和NaOH 反应能生成RCOONa和R′OH,下列叙述正确的是( )
和NaOH 反应能生成RCOONa和R′OH,下列叙述正确的是( )| A. | M的相对分子质量是180 | |
| B. | 1mol M最多能与2molBr2发生反应 | |
| C. | 1molM与足量的NaOH溶液发生反应,所得有机产物的化学式为C9H4O5Na4 | |
| D. | 1molM与足量NaHCO3反应能生成2molCO2 |
| A. | 20% | B. | 25% | C. | 33% | D. | 35% |
| A. | 一定互为同分异构体 | B. | 一定互为同系物 | ||
| C. | 具有相同的最简式 | D. | 烃中碳原子数一定相同 |
| A. | 该有机物可能是羧酸 | |
| B. | 该有机物可能是酯 | |
| C. | 该有机物可能含有碳碳双键 | |
| D. | 将该有机物和CH4混合,共5mol,完全燃烧,共消耗10mol O2 |