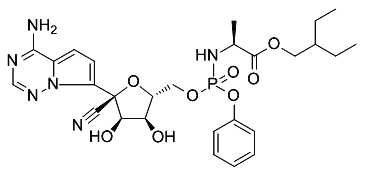
题目内容
【题目】铁和铜都是日常生活中常见的金属,有着广泛的用途。请回答下列问题:
(1)配合物Fe(CO)x常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断Fe(CO)x晶体属于__________(填晶体类型);Fe(CO)x的中心原子价电子数与配体提供电子数之和为18,则x=_____________;![]() 的核外电子排布式为_____________________。
的核外电子排布式为_____________________。
(2)![]() 溶液可用于检验_________(填离子符号);
溶液可用于检验_________(填离子符号);![]() 中碳原子杂化轨道类型为_____;1mol
中碳原子杂化轨道类型为_____;1mol![]() 含有的π键数目为_______(用N表示);C、N、O第一电离能由大到小的顺序为_________(用元素符号表示)。
含有的π键数目为_______(用N表示);C、N、O第一电离能由大到小的顺序为_________(用元素符号表示)。
(3)某M原子的外围电子排布式为![]() ,铜与M形成的某化合物的晶胞结构如下图所示(黑点代表铜原子)。
,铜与M形成的某化合物的晶胞结构如下图所示(黑点代表铜原子)。
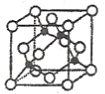
①该晶体的化学式为__________________。
②已知铜和M的电负性分别为1.9和3.0,则铜与M形成的化合物属于___________(填“离子”或“共价”)化合物。
③已知该晶体的密度为![]() ,阿伏加德罗常数为
,阿伏加德罗常数为![]() ,则该晶体中铜原子和M原子之间的最短距离为____________________pm(只需写出计算式)。
,则该晶体中铜原子和M原子之间的最短距离为____________________pm(只需写出计算式)。
【答案】分子晶体 5 ![]() 或
或![]()
![]() sp 2
sp 2![]() N>O>C CuCl 共价
N>O>C CuCl 共价 ![]() 或
或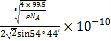 或
或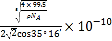
【解析】
(1)Fe(CO)x常温下呈液态,熔沸点较低,易溶于非极性溶剂,符合分子晶体的特点,因此Fe(CO)x属于分子晶体;中心原子铁价电子数为8,配体CO提供2个电子形成配位键,因此x=(18-8)/2=5;![]() 的核外电子排布式为
的核外电子排布式为![]() 或
或![]() ;
;
(2)含Fe2+的溶液与铁氰化钾K3[Fe(CN)6]溶液反应生成具有特征蓝色的铁氰化亚铁沉淀,所以![]() 溶液可用于检验
溶液可用于检验![]() ;C、N之间是叁键,CN-中C有一个孤电子对,CN-中心原子C价电子对数2,C杂化轨道类型为sp;C、N之间是叁键,1mol
;C、N之间是叁键,CN-中C有一个孤电子对,CN-中心原子C价电子对数2,C杂化轨道类型为sp;C、N之间是叁键,1mol![]() 含有的π键数目为2
含有的π键数目为2![]() ;C、N、O属于同一周期,电离能同周期从左向右增大,但是第ⅡA族大于第ⅢA族,第ⅤA族大于ⅥA族,因此N>O>C;
;C、N、O属于同一周期,电离能同周期从左向右增大,但是第ⅡA族大于第ⅢA族,第ⅤA族大于ⅥA族,因此N>O>C;
(3)①M原子的外围电子排布式3s23p5,M是第三周期第ⅦA族元素,即Cl,铜在晶胞占有的位置为8个顶点、6个面,铜原子的个数8×1/8+6×1/2=4,Cl原子在晶胞的位置在体心,全部属于晶胞,Cl个数是4,化学式:CuCl;
②一般认为两个成键元素原子间的电负性差值大于1.7形成离子键,小于1.7形成共价键,铜与Cl电负性差值3.0-1.9=1.1<1.7,该化合物属于共价化合物;
③设边长为acm,ρ=![]() ,a=
,a=![]() ,该晶胞类似与金刚石的晶胞,Cu和Cl最近的距离是体对角线的1/4,即距离为:
,该晶胞类似与金刚石的晶胞,Cu和Cl最近的距离是体对角线的1/4,即距离为:![]() pm。
pm。

 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案