题目内容
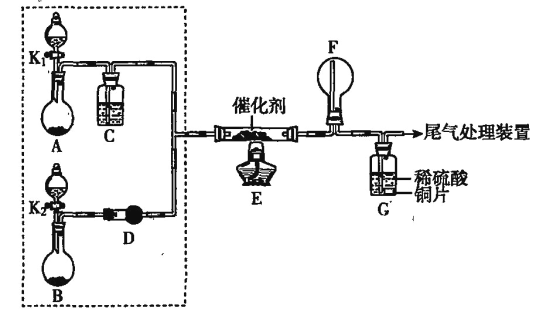
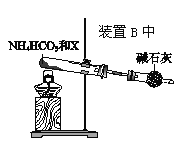
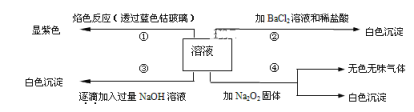
【题目】有一无色溶液,其中可能含有Fe3+、Al3+、Fe2+、Mg2+、Cu2+、Ba2+、K+、Cl-、SO42-等离子的几种,为分析其成分,取此溶液分别进行了四个实验,其操作和有关现象如下图所示:
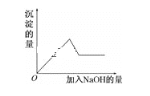
第③个实验中,生成白色沉淀的量与加入NaOH的量有如图所示的相互关系。据此可知:
(1)在原溶液中一定存在的离子有___________________________。
(2)写出第③个实验中发生反应的离子方程式___________________。
(3)第④个实验中加入Na2O2固体发生反应时氧化剂与还原剂的物质的量之比为_____。
【答案】Al3+、Mg2+、K+、SO42- Mg2++2OH-=Mg(OH)2↓ 、Al3++3OH-=Al(OH)3↓、Al(OH)3 +OH-=AlO2-+2H2O 1:1
【解析】
无色溶液中Fe3+、Fe2+和Cu2+不存在,因此溶液中一定不存在Fe3+、Fe2+和Cu2+,透过蓝色的钴玻璃看到焰色为紫色,说明一定存在K+,根据实验③的曲线图可知,向溶液中逐滴加入过量的NaOH,沉淀的量先增大,后沉淀溶解,最终沉淀质量不变,说明溶液中一定有Mg2+和Al3+,加入BaCl2溶液和稀盐酸,有白色沉淀,说明溶液中一定有SO42-,根据已知的信息无法确定溶液中是否含有Cl-,据此作答。
(1)由分析可知,溶液中一定存在的离子是:Al3+、Mg2+、K+、SO42-;
(2)实验③中Al3+、Mg2+与NaOH反应生成Al(OH)3、Mg(OH)2白色沉淀,NaOH过量后Al(OH)3溶解,Mg(OH)2不溶,发生的离子反应为:Mg2++2OH-=Mg(OH)2↓ 、Al3++3OH-=Al(OH)3↓、Al(OH)3 +OH-=AlO2-+2H2O;
(3)第④个实验中加入Na2O2固体,发生的反应为:2Na2O2+2H2O=4NaOH+O2↑,其中Na2O2既作氧化剂又作还原剂,氧化剂与还原剂的物质的量之比为1:1。

 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案 小学课堂作业系列答案
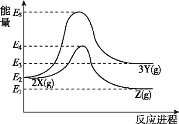
小学课堂作业系列答案【题目】氨气可有效消除NO2的污染,相关反应为8NH3+6NO27N2+12H2O,在1 L恒容密闭容器中,控制不同温度,分别加入0.50 mol NH3和1.2 mol NO2,测得n(NH3)随时间变化的有关实验数据如下表。
温度 n(NH3)/mol 时间/min | 0 | 10 | 20 | 40 | 50 |
T1 | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
T2 | 0.50 | 0.30 | 0.20 | … | 0.18 |
下列说法正确的是( )
A.T1温度下,0-20 min内,NO2的降解速率为0.0125 molL-1min-1
B.实验条件为T1<T2,且该反应为放热反应
C.40 min时,表格中T2对应的数据为0.20
D.0~10 min内,T1温度下NH3的降解速率大于T2温度下的