题目内容
【题目】已知草酸为二元弱酸:常温下,向某浓度的草酸溶液中逐滴加入一定量浓度的KOH溶液,所得溶液中H2C2O4、HC2O4﹣、C2O42﹣三种微粒的物质的量分数(δ)与溶液pH的关系如图所示,则下列说法中不正确的是
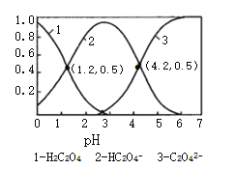
A. pH=1.2溶液中:c(K+)+c(H+)═c(OH﹣)+c(H2C2O4)
B. H2C2O4的第一步电离,平衡常数为10-1.2
C. 将相同物质的量KHC2O4和K2C2O4固体完全溶于水所得混合液的pH为4.2
D. 向pH=1.2的溶液中加KOH溶液将pH增大至4.2的过程中水的电离程度增大
【答案】C
【解析】
A. 由图像知pH=1.2溶液中δ(H2C2O4)=δ(HC2O4-)=0.5,即c(H2C2O4)=c(HC2O4-),根据电荷守恒有等式c(K+)+c(H+)=c(OH-)+c(HC2O4-),将等式中c(HC2O4-)替换为c(H2C2O4),故得c(K+)+c(H+)=c(OH-)+c(H2C2O4),A项正确;
B. 因电离平衡常数只与温度有关,选取图像上pH=1.2,δ(H2C2O4)=δ(HC2O4-)=0.5,由H2C2O4的第一步电离方程式H2C2O4![]() H++HC2O4-,得平衡常数Ka1=
H++HC2O4-,得平衡常数Ka1=![]() =c(H+)=10-1.2,B项正确;
=c(H+)=10-1.2,B项正确;
C. 由图像知pH=4.2时HC2O4-电离常数Ka2=![]() =c(H+)=10-4.2,C2O42-的水解C2O42-+H2O
=c(H+)=10-4.2,C2O42-的水解C2O42-+H2O![]() HC2O4-+OH-平衡常数Kh=
HC2O4-+OH-平衡常数Kh=![]() =
=![]() =
=![]() =
=![]() =10-9.8,Ka2≠Kh,即HC2O4-电离程度与C2O42-的水解程度不相同,所以相同物质的量KHC2O4和K2C2O4完全溶于水所得溶液中δ(HC2O4-)≠δ(C2O42-),故所得溶液的pH≠4.2,C项错误;
=10-9.8,Ka2≠Kh,即HC2O4-电离程度与C2O42-的水解程度不相同,所以相同物质的量KHC2O4和K2C2O4完全溶于水所得溶液中δ(HC2O4-)≠δ(C2O42-),故所得溶液的pH≠4.2,C项错误;
D.由图像知pH=1.2时H2C2O4电离出来的H+抑制了水的电离,加KOH溶液发生反应H2C2O4+KOH=KHC2O4+H2O,H2C2O4浓度逐渐减小,H+浓度逐渐减小,水的电离平衡向右移动;当pH>3时发生反应HC2O4-+OH-=C2O42-+H2O,C2O42-浓度逐渐增大,C2O42-因水解促进水的电离,所以整个过程中水的电离程度逐渐增大,D项正确;答案选C。

【题目】下列实验操作对应的现象符合事实的是( )
|
|
|
|
A.将绿豆大小的金属钠投入蒸馏水中,钠块熔成小球,浮于水面,迅速游 动,溶液变红 | B.将甲烷与氯气1∶1混合,在光照条件下反应,黄绿色褪去,水面上升,充满集气瓶 | C.将5g碳酸钙投入20mL1mol·L-1盐酸,针筒活塞向右移动的速率先逐渐增大,然后减小 | D.将铜片与浓硫酸混合加热,品红溶液变红,试管内出现蓝色固体和 少量黑色物质 |
A.AB.BC.CD.D