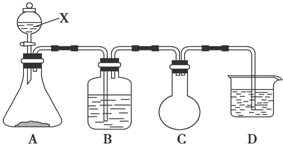
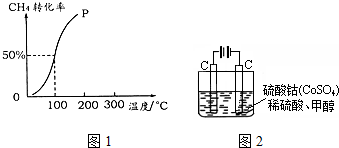
题目内容
20.分子式为C5H12O的醇与分子式为C5H10O2的羧酸形成的酯共有(不考虑立体异构)( )| A. | 24种 | B. | 28种 | C. | 32种 | D. | 40种 |
分析 根据分子式为C5H10O2的酸的种类取决于-C4H9的种类,分子式为C5H12O的醇的种类取决于-C5H11的种类;-C4H9异构体有4种:-CH2CH2CH2CH3,-CH(CH3)CH2CH3,-CH2CH(CH3)CH3,-C(CH3)3,-C5H11的异构体有8种:-CH2CH2CH2CH2CH3、-CH(CH3)CH2CH2CH3、-CH(CH2CH3)2、-CHCH(CH3)CH2CH3、-C(CH3)2CH2CH3、-C(CH3)CH(CH3)2、-CH2CH2CH(CH3)2、-CH2C(CH3)3,据此确定二者形成的酯的种类.
解答 解:分子式为C5H10O2的酸的种类取决于-C4H9的种类,-C4H9异构体有4种:-CH2CH2CH2CH3,-CH(CH3)CH2CH3,-CH2CH(CH3)CH3,-C(CH3)3,则分子式为C5H10O2的酸有4种;
分子式为C5H12O的醇的种类取决于-C5H11的种类,-C5H11的异构体有8种:-CH2CH2CH2CH2CH3、-CH(CH3)CH2CH2CH3、-CH(CH2CH3)2、-CHCH(CH3)CH2CH3、-C(CH3)2CH2CH3、-C(CH3)CH(CH3)2、-CH2CH2CH(CH3)2、-CH2C(CH3)3,则分子式为C5H12O的醇有8种,
所以分子式为C5H12O的醇与分子式为C5H10O2的羧酸形成的酯共有:4×8=32种,
故选C.
点评 本题考查了同分异构体数目的计算,题目难度中等,明确“C5H10O2的酸的种类取决于-C4H9的种类,分子式为C5H12O的醇的种类取决于-C5H11的种类”为解答关键,注意掌握同分异构体的书写原则.

练习册系列答案
 课前课后同步练习系列答案
课前课后同步练习系列答案 课堂小作业系列答案
课堂小作业系列答案 黄冈小状元口算速算练习册系列答案
黄冈小状元口算速算练习册系列答案 成功训练计划系列答案
成功训练计划系列答案 倍速训练法直通中考考点系列答案
倍速训练法直通中考考点系列答案 一卷搞定系列答案
一卷搞定系列答案 名校作业本系列答案
名校作业本系列答案
相关题目
8.与苯环上的碳氢键相比,甲苯中的侧链甲基或苯酚中的羟基对苯环上的碳氢键的化学活泼性具有较大影响,下列关于甲苯或苯酚的实验事实中,能说明侧链或羟基对苯环有影响的是( )
| A. | 甲苯能使酸性高锰酸钾溶液褪色 | |
| B. | 甲苯能与浓硝酸、浓硫酸反应生成TNT | |
| C. | 苯酚能与FeCl3溶液发生显色反应 | |
| D. | 苯酚具有酸性,能与碳酸钠溶液发生反应 |
5.2007年度诺贝尔化学奖,授予致力于研究合成氨与催化剂表面积大小关系的德国科学家格哈德•艾特尔,表彰他在“固体表面化学过程”研究中作出的贡献.下列说法正确的是( )
| A. | 使用催化剂,能增大氢气的转化率 | |
| B. | 增大催化剂的表面积,能加快合成氨的正反应速率、降低逆反应速率 | |
| C. | 采用正向催化剂时,反应的活化能降低,使反应明显加快 | |
| D. | 工业生产中,合成氨采用的压强越高,温度越低,越有利于提高经济效益 |
12.下列离子方程式正确的是( )
| A. | HCO3-水解的离子方程式:HCO3-+H2O?CO32-+H3O+ | |
| B. | 用铜为电极电解饱和食盐水:2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$Cl2↑+H2+2OH- | |
| C. | 氨水溶解氯化银固体:AgCl+2NH3•H2O═[Ag(NH3)2]++Cl-+2H2O | |
| D. | 将饱和FeCl3溶液滴入沸水中制取Fe(OH)3胶体:Fe3++3H2O?Fe(OH)3↓+3H+ |
9.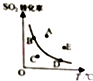 对于可逆反应:2SO2(g)+O2(g)?2SO2(g)△H<0,下图表示SO2的转化率与温度的关系,图上标有A、B、C、D、E五个点,其中能表示反应未达到平衡状态,且正反应速率大于逆反应速率的是( )
对于可逆反应:2SO2(g)+O2(g)?2SO2(g)△H<0,下图表示SO2的转化率与温度的关系,图上标有A、B、C、D、E五个点,其中能表示反应未达到平衡状态,且正反应速率大于逆反应速率的是( )
 对于可逆反应:2SO2(g)+O2(g)?2SO2(g)△H<0,下图表示SO2的转化率与温度的关系,图上标有A、B、C、D、E五个点,其中能表示反应未达到平衡状态,且正反应速率大于逆反应速率的是( )
对于可逆反应:2SO2(g)+O2(g)?2SO2(g)△H<0,下图表示SO2的转化率与温度的关系,图上标有A、B、C、D、E五个点,其中能表示反应未达到平衡状态,且正反应速率大于逆反应速率的是( )| A. | A点 | B. | B、D两点 | C. | C点 | D. | A、E两点 |
10.下列关于同分异构体的说法中正确的是( )
| A. | 相对分子质量相同,结构不同的化合物互为同分异构体 | |
| B. | 同分异构体间的相互转化不存在能量的变化 | |
| C. | C4H10的一氯代物共2种结构 | |
| D. | 甲苯( )苯环上的氢原子被一个氯原子取代后的产物共有3种 )苯环上的氢原子被一个氯原子取代后的产物共有3种 |
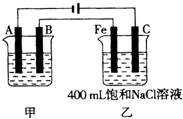 (Ⅰ)采用系统命名法:写出下列各烃的名称
(Ⅰ)采用系统命名法:写出下列各烃的名称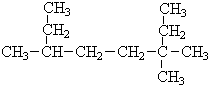 ,3,3,6-三甲基辛烷
,3,3,6-三甲基辛烷