题目内容
7.对于反应N2(g)+3H2O(g)═2NH3(g)+$\frac{3}{2}$O2(g),在不同时间段内所测反应速率见选项,则表示该化学反应进行最快的是( )| A. | v(N2)=1.5 mol•(L•min)-1 | B. | v(NH3)=1.8 mol•(L•min)-1 | ||
| C. | v(H2O)=2.67 mol•(L•min)-1 | D. | v(O2)=1.5 mol•(L•min)-1 |
分析 不同物质表示的速率之比等于其化学计量数之比,故不同物质表示的速率与其化学计量数的比值越大,表示的反应速率越快,注意单位要一致.
解答 解:不同物质表示的速率之比等于其化学计量数之比,故不同物质表示的速率与其化学计量数的比值越大,表示的反应速率越快.
A.$\frac{v({N}_{2})}{1}$=1.5 mol•(L•min)-1;
B.$\frac{v(N{H}_{3})}{2}$=0.9 mol•(L•min)-1;
C.$\frac{v({H}_{2}O)}{3}$=0.89 mol•(L•min)-1;
D.$\frac{v({O}_{2})}{\frac{3}{2}}$=1mol•(L•min)-1,
故用氮气表示的反应速率最快,
故选A.
点评 本题考查化学反应速率快慢的比较,可以转化为同一物质表示的速率进行比较,注意单位保持一致,难度不大

练习册系列答案
 欣语文化快乐暑假沈阳出版社系列答案
欣语文化快乐暑假沈阳出版社系列答案
相关题目
17.检验居室中有甲醛气体,可连续多次抽取居室空气样品,注入到低浓度(1×10-4mol/L)的酸性高锰酸钾溶液中.据此,下列说法正确的是( )
| A. | 最终酸性高锰酸钾溶液褪色 | B. | 反应中甲醛被还原 | ||
| C. | 最终酸性高锰酸钾溶液是红色 | D. | 说明甲醛是具有氧化性的气体 |
18.下列叙述正确的是( )
| A. | 1molMg2+的质量为24g/mol | B. | 0.5molCH4中含有3.01×1023个电子 | ||
| C. | 3.01×1023个SO2分子的质量为32g | D. | CH4的摩尔质量为16g |
15.CoCl2•6H2O是一种饲料营养强化剂.一种利用水钴矿(主要成分为Co2O3、Co(OH)3,还含少量Fe2O3、Al2O3、MnO等)制取CoCl2•6H2O的工艺流程如图:

已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:(金属离子浓度为:0.01mol/L)
③CoCl2•6H2O熔点为86℃,加热至110~120℃时,失去结晶生成无水氯化钴.
(1)写出浸出过程中Co2O3发生反应的离子方程式Co2O3+SO32-+4H+=2Co2++SO42-+2H2O.
(2)写出NaClO3发生反应的主要离子方程式ClO3-+6Fe2++6H+=Cl-+6Fe3++3H2O;若不慎向“浸出液”中加过量NaClO3时,可能会生成有毒气体,写出生成该有毒气体的离子方程式ClO3-+5Cl-+6H+=3Cl2↑+3H2O.
(3)“加Na2CO3调pH至5.2”,过滤所得到的沉淀成分为Fe(OH)3、Al(OH)3,加入萃取剂的目的是除去溶液中的Mn2+.
(4)制得的CoCl2•6H2O在烘干时需减压烘干的原因是降低烘干温度,防止产品分解.
(5)为测定粗产品中CoCl2•6H2O含量,称取一定质量的粗产品溶于水,加入足量HNO3酸化的AgNO3溶液,过滤、洗涤,将沉淀烘干后称其质量.通过计算发现粗产品中CoCl2•6H2O的质量分数大于100%,其原因可能是粗产品含有可溶性氯化物或晶体失去了部分结晶水.(答一条即可)

已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:(金属离子浓度为:0.01mol/L)
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(1)写出浸出过程中Co2O3发生反应的离子方程式Co2O3+SO32-+4H+=2Co2++SO42-+2H2O.
(2)写出NaClO3发生反应的主要离子方程式ClO3-+6Fe2++6H+=Cl-+6Fe3++3H2O;若不慎向“浸出液”中加过量NaClO3时,可能会生成有毒气体,写出生成该有毒气体的离子方程式ClO3-+5Cl-+6H+=3Cl2↑+3H2O.
(3)“加Na2CO3调pH至5.2”,过滤所得到的沉淀成分为Fe(OH)3、Al(OH)3,加入萃取剂的目的是除去溶液中的Mn2+.
(4)制得的CoCl2•6H2O在烘干时需减压烘干的原因是降低烘干温度,防止产品分解.
(5)为测定粗产品中CoCl2•6H2O含量,称取一定质量的粗产品溶于水,加入足量HNO3酸化的AgNO3溶液,过滤、洗涤,将沉淀烘干后称其质量.通过计算发现粗产品中CoCl2•6H2O的质量分数大于100%,其原因可能是粗产品含有可溶性氯化物或晶体失去了部分结晶水.(答一条即可)
2.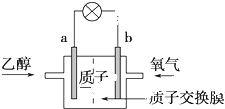 一种新型乙醇电池用磺酸类质子做溶剂,比甲醇电池效率高出32倍.电池示意图如图 所示:电池总反应为C2H5OH+3O2═2CO2+3H2O.下列对该电池的说法正确的是( )
一种新型乙醇电池用磺酸类质子做溶剂,比甲醇电池效率高出32倍.电池示意图如图 所示:电池总反应为C2H5OH+3O2═2CO2+3H2O.下列对该电池的说法正确的是( )
 一种新型乙醇电池用磺酸类质子做溶剂,比甲醇电池效率高出32倍.电池示意图如图 所示:电池总反应为C2H5OH+3O2═2CO2+3H2O.下列对该电池的说法正确的是( )
一种新型乙醇电池用磺酸类质子做溶剂,比甲醇电池效率高出32倍.电池示意图如图 所示:电池总反应为C2H5OH+3O2═2CO2+3H2O.下列对该电池的说法正确的是( )| A. | b极为电池的负极 | |
| B. | 电池工作时电子由b极沿导线经灯泡再到a极 | |
| C. | 当1 mol乙醇被氧化转移12NA个电子 | |
| D. | 电池负极的电极反应为4H++O2+4e-═2H2O |
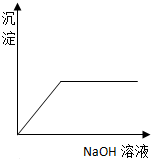
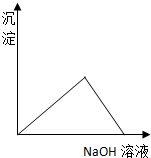
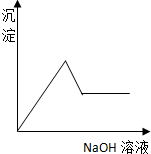
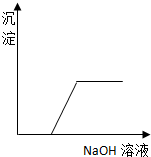
12.如图表示向AlCl3溶液滴加NaOH溶液过程中铝元素存在的微粒关系曲线不正确的是( )
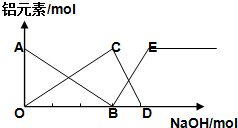

| A. | AB线表示Al3+的物质的量的变化 | B. | OC表示AlO2-的物质的量的变化 | ||
| C. | CD线表示Al(OH)3的物质的量的变化 | D. | BE线表示AlO2-的物质的量的变化 |
19.已知 X、Y、Z、Q、R、E六种元素中,原子序数X<Y<Z<Q<R<E,其结构或性质信息如下表.
请根据信息回答有关问题:
(1)元素Y的原子核外共有7种不同运动状态的电子,有3种不同能级的电子.
(2)X、Y、Z三种元素的电负性由高到低的排列次序依次为(写元素符号)O、N、C.
(3)X、Z、Q元素均表现最低化合价时的三种氢化物中,沸点由高到低的排列次序依次为(写化学式)H2O>HCl>CH4.
(4)R的最高化合价为+6.R的一种配合物的化学式为RCl3•6H2O.已知0.01molRCl3•6H2O在水溶液中用过量硝酸银溶液处理,产生0.02mol AgCl沉淀.此配合物最可能是B.
A.[R(H2O)6]Cl3 B.[R(H2O)5Cl]Cl2•H2O
C.[R(H2O)4Cl2]Cl•2H2O D.[R(H2O)3Cl3]•3H2O
(5)元素E能形成八面体构型的配合物离子[E(YH3)xQ2]+,则中心离子为(写化学式)Co3+,配位体为(写化学式)NH3和Cl-,x 的值为4.
| 元素 | 结构或性质信息 |
| X | 原子的L层上s电子数等于p电子数. |
| Y | 原子核外的L层有3个未成对电子. |
| Z | 在元素周期表的各元素中电负性仅小于氟. |
| Q | 单质常温、常压下是气体,原子的M层上有1个未成对的p电子. |
| R | 核电荷数是Y与Q的核电荷数之和 |
| E | 原子序数比R大3 |
(1)元素Y的原子核外共有7种不同运动状态的电子,有3种不同能级的电子.
(2)X、Y、Z三种元素的电负性由高到低的排列次序依次为(写元素符号)O、N、C.
(3)X、Z、Q元素均表现最低化合价时的三种氢化物中,沸点由高到低的排列次序依次为(写化学式)H2O>HCl>CH4.
(4)R的最高化合价为+6.R的一种配合物的化学式为RCl3•6H2O.已知0.01molRCl3•6H2O在水溶液中用过量硝酸银溶液处理,产生0.02mol AgCl沉淀.此配合物最可能是B.
A.[R(H2O)6]Cl3 B.[R(H2O)5Cl]Cl2•H2O
C.[R(H2O)4Cl2]Cl•2H2O D.[R(H2O)3Cl3]•3H2O
(5)元素E能形成八面体构型的配合物离子[E(YH3)xQ2]+,则中心离子为(写化学式)Co3+,配位体为(写化学式)NH3和Cl-,x 的值为4.
17.为探究NaHCO3、Na2CO3和盐酸(以下盐酸浓度均为1mol•L-1)反应过程中的热效应,实验测得如下数据:
由此得出的结论正确的是( )
| 序号 | 35mL试剂 | 固体 | 混合前 温度/℃ | 混合后 温度/℃ |
| ① | 水 | 2.5g NaHCO3 | 20.0 | 18.5 |
| ② | 水 | 3.2g Na2CO3 | 20.0 | 24.3 |
| ③ | 盐酸 | 2.5g NaHCO3 | 20.0 | 16.2 |
| ④ | 盐酸 | 3.2g Na2CO3 | 20.0 | 25.1 |
| A. | Na2CO3溶液与盐酸的反应是吸热反应 | |
| B. | NaHCO3溶液与盐酸的反应是放热反应 | |
| C. | 20.0℃时,含3.2 g Na2CO3的饱和溶液和35 mL盐酸混合后的温度将低于25.1℃ | |
| D. | 20.0℃时,含2.5 g NaHCO3的饱和溶液和35 mL盐酸混合后的温度将低于16.2℃ |