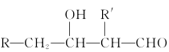题目内容
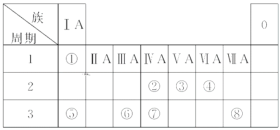
【题目】下表为元素周期表的一部分,针对表中①~⑧元素,回答下列问题
① | |||||||||||||||
② | ③ | ④ | |||||||||||||
⑤ | ⑥ | ⑦ | ⑧ |
(1)③元素在周期表中的位置是第二周期第_____________族
(2)写出②的最高价氧化物的电子式_____________
(3)⑤和⑥两种元素的最高价氧化物对应水化物中碱性较强的是_____________(填化学式)
(4)写出③和⑦的常见氢化物中稳定性较好的的物质的电子式_____________
(5)写出⑤⑧的最高价氧化物对应水化物互相反应的离子方程式_____________
【答案】VIA ![]() NaOH
NaOH ![]() H++OH-=H2O
H++OH-=H2O
【解析】
根据各元素在周期表中的位置可以知道,①为H元素,②为C元素,③为O元素,④为F元素,⑤为Na元素,⑥为Al元素,⑦为S元素,⑧为Cl元素,据此回答。
(1)氧元素在周期表中的位置是第二周期第VIA族,故答案为:VIA;
(2)碳的最高价氧化物为二氧化碳,二氧化碳是共价化合物,C与O之间存在二个共用电子对,其电子式为![]() ,故答案为:
,故答案为:![]() ;
;
(3)金属性:Na>Al,则最高价氧化物对应水化物的碱性:NaOH>Al(OH)3,故答案为:NaOH;
(4)非金属性:O>S,则氢化物的稳定性:H2O>H2S,H2O的电子式:![]() ,故答案为:
,故答案为:![]() ;
;
(5)元素⑧的最高价氧化物对应的水化物为HClO4,元素⑤最高价氧化物对应的水化物为NaOH,二者发生反应的离子方程式为H++OH-=H2O,故答案为:H++OH-=H2O。

练习册系列答案
相关题目