题目内容
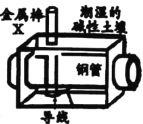
【题目】如图所示,水槽中试管内有一枚铁钉,放置数天观察:

(1)铁钉在逐渐生锈,则铁钉的腐蚀属于_____腐蚀。
(2)若试管内液面上升,则原溶液是_____性,发生______腐蚀,电极反应:负极:_______,正极:________。
(3)若试管内液面下降,则原溶液是_____性,发生______腐蚀,电极反应:负极:_______,正极:______________。
(4)若溶液甲为水,溶液乙为海水,则铁钉在____(填“甲”或“乙”)溶液中腐蚀的速度快。
【答案】电化学 弱酸性或中性 吸氧 Fe—2e-=Fe2+ O2 + 2H2O+4e-=4OH- 较强的酸性 析氢 Fe—2e-=Fe2+ 2 H++ 2e-= H2↑ 乙
【解析】
将一枚铁钉放置在水槽中的试管内,因铁钉周围存在着大量的电解质溶液,因此铁钉的腐蚀主要以电化学腐蚀为主;若原溶液呈弱酸性或中性,则铁钉主要发生吸氧腐蚀,试管内液面将上升;若原溶液具有较强的酸性,则铁钉主要发生析氢腐蚀,试管内液面将下降。
(1)将一枚铁钉放置在水槽中的试管内,因铁钉周围存在着大量的电解质溶液,因此铁钉的腐蚀主要以电化学腐蚀为主;
(2)若试管内液面上升,则说明铁钉在发生腐蚀的过程中吸收了一些气体,即发生了吸氧腐蚀。因此原溶液应是弱酸性或中性溶液 ,其发生的电极反应应为:负极: Fe—2e-=Fe2+,正极: O2 + 2H2O+4e-=4OH-;
(3)若试管内液面下降,则说明铁钉在发生腐蚀的过程中释放了一些气体,即发生了析氢腐蚀。则原溶液具有较强的酸性,电极反应:负极: Fe—2e-=Fe2+,正极: 2 H++ 2e-= H2↑;
(4)若溶液甲为水,溶液乙为海水,则铁钉在离子浓度越高的电解质溶液中发生电化学腐蚀的速度越快。因此铁钉在乙溶液中腐蚀的速度快。

【题目】下表为元素周期表的一部分,针对表中①~⑧元素,回答下列问题
① | |||||||||||||||
② | ③ | ④ | |||||||||||||
⑤ | ⑥ | ⑦ | ⑧ |
(1)③元素在周期表中的位置是第二周期第_____________族
(2)写出②的最高价氧化物的电子式_____________
(3)⑤和⑥两种元素的最高价氧化物对应水化物中碱性较强的是_____________(填化学式)
(4)写出③和⑦的常见氢化物中稳定性较好的的物质的电子式_____________
(5)写出⑤⑧的最高价氧化物对应水化物互相反应的离子方程式_____________