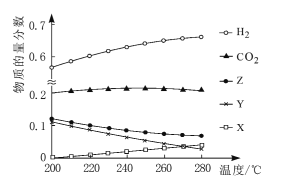
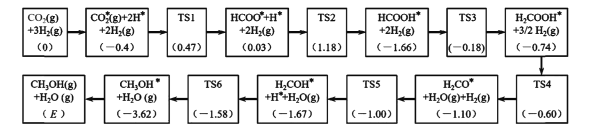
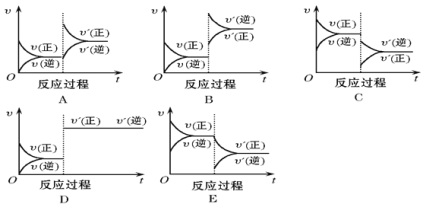
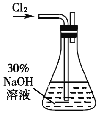
题目内容
【题目】大型客机燃油用四乙基铅[Pb(CH2CH3)4])做抗震添加剂,但皮肤长期接触四乙基铅对身体健康有害,可用硫基乙胺(HSCH2CH2NH2)和KMnO4清除四乙基铅。
(1)碳原子核外电子的空间运动状态有______种,基态锰原子的外围电子排布式为___,该原子能量最高的电子的电子云轮廓图形状为________。
(2)N、C和Mn电负性由大到小的顺序为____________。
(3)HSCH2CH2NH2中C的杂化方式为_____,其中NH2-空间构型为____;N和P的价电子相同,但磷酸的组成为H3PO4,而硝酸的组成不是H3NO4,其原因是_______。
(4)Pb(CH2CH3)4是一种难电离且易溶于有机溶剂的配合物,其晶体类型属于_____晶体。已知Pb(CH2CH3)4晶体的堆积方式如下。
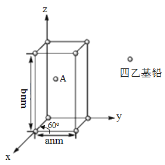
Pb(CH2CH3)4]在xy平面上的二维堆积中的配位数是___,A分子的坐标参数为_____;设阿伏加德罗常数为NA/mol,Pb(CH2CH3)4]的摩尔质量为Mg/mol,则Pb(CH2CH3)4]晶体的密度是_____g/cm3 (列出计算式即可)。
【答案】6 3d54s2 球形 N>C>Mn sp3 V型 N原子半径较小,不能容纳较多的原子轨道,故不能形成H3NO4 分子 6 ![]()
![]()
【解析】
(1)原子核外电子运动状态和该原子的核外电子数相等,原子序数为27的锰元素基态原子的外围电子排布式为3d54s2,据此可以得出锰元素在周期表中的位置是第四周期第ⅤⅡB族,能量最高的电子是4s2电子,4s电子的电子云轮廓图为球形;
(2)电负性是金属性与非金属性定量描述的一个物理量,元素的非金属性越强,往往其电负性越大,根据元素周期表中元素非金属性(或电负性)的递变规律,同周期从左到右元素电负性增大;
(3)HSCH2CH2NH2分子中,C形成4个共价键,它们价层电子对数为4对,其杂化方式为sp3,在-NH2中N有两个单键,一对孤对电子和一个单电子,因为单电子也需要占用一个轨道,所以N的价层电子对数依然可以视为4对,其杂化方式也为sp3,考虑配位原子只有两个H,所以其空间构型为平面三角形,N和P为同族元素,其价层电子数相同,通常情况下其成键方式相同,但是由于N原子半径小于P,N原子周围空间无法容纳4个氧原子成键;
(4)题目信息,Pb(CH2CH3)4是一种难电离且易溶于有机溶剂的配合物,可知其晶体类型为分子晶体,这一点也可以从Pb(CH2CH3)4晶体的堆积方式得到结论,Pb(CH2CH3)4晶体堆积方式为六方密堆积,所以在xy平面上的二维堆积中也采取二维最密堆积即配位数为6,由堆积图可知每个晶胞中包含2个Pb(CH2CH3)4分子,所以每一个晶胞的质量为![]() g,再结合晶胞参数,长方体的棱边长度,计算得到晶胞的体积为
g,再结合晶胞参数,长方体的棱边长度,计算得到晶胞的体积为![]() cm3,则Pb(CH2CH3)4晶体的密度=
cm3,则Pb(CH2CH3)4晶体的密度=![]() 。
。
(1)碳原子核外电子排布为1s22s22p2,核外电子的空间运动状态有6种,原子序数为27的锰元素基态原子的外围电子排布式为3d54s2,据此可以得出锰元素在周期表中的位置是第四周期第ⅤⅡB族,能量最高的电子是4s2电子,值得注意的是,教材上提供的构造原理是原子填充顺序规则,并不代表电子的能量高低,在金属元素的原子中,最易失去的电子才是该原子能量最高的电子,4s电子的电子云轮廓图为球形,故答案为:6;3d54s2;球形;
(2)电负性是金属性与非金属性定量描述的一个物理量,元素的非金属性越强,往往其电负性越大,根据元素周期表中元素非金属性(或电负性)的递变规律,同周期从左到右元素电负性增大,可以得到电负性大小为N大于C,而Mn为金属元素,其电负性小于非金属性,N、C和Mn三种元素的电负性由大到小的顺序为:N、C、Mn,故答案为:N、C、Mn;
(3)HSCH2CH2NH2分子中,C形成4个共价键,它们价层电子对数为4对,其杂化方式为sp3,在-NH2中N有两个单键,一对孤对电子和一个单电子,因为单电子也需要占用一个轨道,所以N的价层电子对数依然可以视为4对,其杂化方式也为sp3,考虑配位原子只有两个H,所以其空间构型为平面三角形,N和P为同族元素,其价层电子数相同,通常情况下其成键方式相同,但是由于N原子半径小于P,N原子周围空间无法容纳4个氧原子成键,所以在其最高价含氧酸中,前者为一元酸后者为三元酸,或说H3NO4分子会因为N原子半径小,无法容纳4个氧原子成键,要脱去一个水分子,以HNO3形式存在,故答案为:sp3;平面三角形;N和P为同族元素,其价层电子数相同,通常情况下其成键方式相同,但是由于N原子半径小于P,N原子周围空间无法容纳4个氧原子成键,所以在其最高价含氧酸中,前者为一元酸后者为三元酸,或说H3NO4分子会因为N原子半径小,无法容纳4个氧原子成键,要脱去一个水分子,以HNO3形式存在;
(4)题目信息,Pb(CH2CH3)4是一种难电离且易溶于有机溶剂的配合物,可知其晶体类型为分子晶体,这一点也可以从Pb(CH2CH3)4晶体的堆积方式得到结论,Pb(CH2CH3)4晶体堆积方式为六方密堆积,所以在xy平面上的二维堆积中也采取二维最密堆积即配位数为6,A分子的坐标参数为(![]() )由堆积图可知每个晶胞中包含2个Pb(CH2CH3)4分子,所以每一个晶胞质量为
)由堆积图可知每个晶胞中包含2个Pb(CH2CH3)4分子,所以每一个晶胞质量为![]() g,再结合晶胞参数,可以得到晶胞的体积为
g,再结合晶胞参数,可以得到晶胞的体积为![]() cm3,则Pb(CH2CH3)4晶体的密度是
cm3,则Pb(CH2CH3)4晶体的密度是![]() g·cm-3,故答案为:分子;6;
g·cm-3,故答案为:分子;6;![]() 。
。