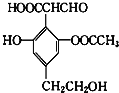
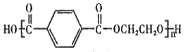
题目内容
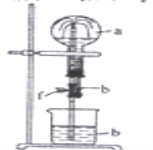
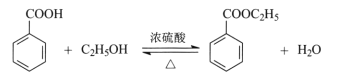
【题目】苯甲酸乙酯可由苯甲酸与乙醇在浓硫酸共热下反应制得,反应装置如图(部分装置省略),反应原理如下:
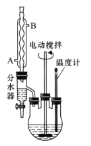
实验操作步骤:
①向三颈烧瓶内加入12.2g苯甲酸、25mL乙醇、20mL苯及4mL浓硫酸,摇匀,加入沸石。
②装上分水器、电动搅拌器和温度计,加热至分水器下层液体接近支管时将下层液体放入量筒中。继续蒸馏,蒸出过量的乙醇,至瓶内有白烟(约3h),停止加热。
③将反应液倒入盛有80mL冷水的烧杯中,在搅拌下分批加入碳酸钠粉末至溶液无二氧化碳逸出,用pH试纸检验至呈中性。
④用分液漏斗分出有机层,水层用25mL乙醚萃取,然后合并至有机层。用无水CaC12干燥,粗产物进行蒸馏,低温蒸出乙醚。当温度超过140℃时,直接接收210-213℃的馏分,最终通过蒸馏得到纯净苯甲酸乙酯12.8mL。
可能用到的有关数据如下:
相对分子质量 | 密度(g/cm3) | 沸点/℃ | 溶解性 | |
苯甲酸 | 122 | 1.27 | 249 | 微溶于水,易溶于乙醇、乙醚 |
苯甲酸乙酯 | 150 | 1.05 | 211-213 | 微溶于热水,溶于乙醇、乙醚 |
乙醇 | 46 | 0.79 | 78.5 | 易溶于水 |
乙醚 | 74 | 0.73 | 34.5 | 微溶于水 |
回答以下问题:
(1)反应装置中分水器上方的仪器名称是______,其作用是____
(2)步骤①中加浓硫酸的作用是_________,加沸石的目的是______。
(3)步骤②中使用分水器除水的目的是_________。
(4)步骤③中加入碳酸钠的目的是________ 。
(5)步骤④中有机层从分液漏斗的____(选填“上口倒出”或“下口放出”)。
(6)本实验所得到的苯甲酸乙酯产率是________%。
【答案】球形冷凝管 冷凝回流,减少反应物乙醇的损失 作催化剂 防止暴沸 及时分离出产物水,促使酯化反应的平衡正向移动 除去硫酸及未反应的苯甲酸 下口放出 89.6
【解析】
根据反应原理![]() ,联系乙酸与乙醇的酯化反应实验的注意事项,结合苯甲酸、乙醇、苯甲酸乙酯、乙醚的性质分析解答(1)~(5);
,联系乙酸与乙醇的酯化反应实验的注意事项,结合苯甲酸、乙醇、苯甲酸乙酯、乙醚的性质分析解答(1)~(5);
(6)根据实验中使用的苯甲酸的质量和乙醇的体积,计算判断完全反应的物质,再根据反应的方程式计算生成的苯甲酸乙酯的理论产量,最后计算苯甲酸乙酯的产率。
(1)根据图示,反应装置中分水器上方的仪器是球形冷凝管,乙醇容易挥发,球形冷凝管可以起到冷凝回流,减少反应物乙醇的损失;
(2) 苯甲酸与乙醇的酯化反应需要用浓硫酸作催化剂,加入沸石可以防止暴沸;
(3) 苯甲酸与乙醇的酯化反应中会生成水,步骤②中使用分水器除水,可以及时分离出产物水,促使酯化反应的平衡正向移动,提高原料的利用率;
(4)步骤③中将反应液倒入盛有80 mL冷水的烧杯中,在搅拌下分批加入碳酸钠粉末,碳酸钠可以与硫酸及未反应的苯甲酸反应生成二氧化碳,因此加入碳酸钠的目的是除去硫酸及未反应的苯甲酸;
(5)根据表格数据,生成的苯甲酸乙酯密度大于水,在分液漏斗中位于下层,分离出苯甲酸乙酯,应该从分液漏斗的下口放出;
(6) 12.2g苯甲酸的物质的量=![]() =0.1mol,25mL乙醇的质量为0.79g/cm3×25mL=19.75g,物质的量为
=0.1mol,25mL乙醇的质量为0.79g/cm3×25mL=19.75g,物质的量为![]() =0.43mol,根据
=0.43mol,根据![]() 可知,乙醇过量,理论上生成苯甲酸乙酯0.1mol,质量为0.1mol×150g/mol=15g,实际上生成苯甲酸乙酯的质量为12.8mL×1.05g/cm3=13.44g,苯甲酸乙酯产率=
可知,乙醇过量,理论上生成苯甲酸乙酯0.1mol,质量为0.1mol×150g/mol=15g,实际上生成苯甲酸乙酯的质量为12.8mL×1.05g/cm3=13.44g,苯甲酸乙酯产率=![]() ×100%=89.6%。
×100%=89.6%。

 名校课堂系列答案
名校课堂系列答案【题目】某合成气的主要成分是一氧化碳和氢气,可用于合成甲醚(CH3OCH3)等清洁燃料。由天然气获得该合成气过程中可能发生的反应有:
①CH4(g)+H2O(g)![]() CO(g)+3H2(g) ΔH1=+206.1 kJ·mol-1
CO(g)+3H2(g) ΔH1=+206.1 kJ·mol-1
②CH4(g)+CO2(g)![]() 2CO(g)+2H2(g) ΔH2=+247.3 kJ·mol-1
2CO(g)+2H2(g) ΔH2=+247.3 kJ·mol-1
③CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH3
CO2(g)+H2(g) ΔH3
请回答下列问题:
(1)在一密闭容器中进行反应①,测得CH4的物质的量浓度随反应时间的变化如图所示,则在10 min时,改变的外界条件可能是__________________________。

(2)反应③中ΔH3=_____________。800 ℃时,反应③的平衡常数K=1,测得该温度下密闭容器中某时刻各物质的物质的量见下表:
CO | H2O | CO2 | H2 |
0.5 mol | 8.5 mol | 2.0 mol | 2.0 mol |
此时反应③中正、逆反应速率的关系式是_________(填代号)。
a.v正>v逆 b.v正<逆 c.v正=v逆 d.无法判断
(3)如图2所示,在甲、乙两容器中分别充入等物质的量的CH4和CO2,使甲、乙两容器初始容积相等。在相同温度下发生反应②,并维持反应过程中温度不变。已知甲容器中CH4的转化率随时间的变化如图3所示,请在图3中画出乙容器中CH4的转化率随时间变化的图像。___________

(4)某合成气的主要成分中的一氧化碳,在一定条件下也可用NaOH溶液与CO反应生成甲酸钠(HCOONa),进一步反应生成甲酸来消除CO污染。常温下将a mol的CO通入2 L b mol·L-1NaOH溶液中,恰好完全反应生成甲酸钠和含少量甲酸的混合溶液(假设溶液体积不变),测得溶液中c(Na+)=c(HCOO-),则该混合溶液中甲酸的电离平衡常数Ka=_________(用含a和b的代数式表示)。
【题目】在如图装置中,烧瓶中充满干燥气体a。将滴管中的液体b挤入烧瓶内,轻轻振荡烧瓶,然后打开弹簧夹f,烧杯中的液体b呈喷泉状喷出,最终几乎充满整个烧瓶。a和b可能是( )
a(干燥气体) |
| |
① | NH3 | 水 |
② | CO2 | 饱和NaOH溶液 |
③ | Cl2 | 饱和食盐水 |
④ | NO2 | 水 |
⑤ | HCl | 0.1 mol·L1AgNO3溶液 |
A. ①②③B. ①②⑤C. ②④⑤D. ①②④