题目内容
氧化铜矿中含有主要杂质为Fe2+和Al3+等,用其生产CuSO4·5H2O主要工艺流程如下图。

(1)图中加入氧化剂的目的是 ,结合下表回答除铁步骤的最佳pH范围为 。

(2)氧化剂若选用KMnO4,会降低产品的纯度,其原因是 ,实际生产中NaClO作为最佳氧化剂,发生反应的离子方程式为 。
(3)请在下图中完善所缺步骤及所添加试剂的化学式。可供选择的操作有:萃取、蒸发浓缩、过滤、洗涤、降温结晶、蒸馏、分液。

(1)图中加入氧化剂的目的是 ,结合下表回答除铁步骤的最佳pH范围为 。

(2)氧化剂若选用KMnO4,会降低产品的纯度,其原因是 ,实际生产中NaClO作为最佳氧化剂,发生反应的离子方程式为 。
(3)请在下图中完善所缺步骤及所添加试剂的化学式。可供选择的操作有:萃取、蒸发浓缩、过滤、洗涤、降温结晶、蒸馏、分液。

(1)将Fe2+氧化成Fe3+,便于沉淀、除杂 3.9≤pH<4.6
(2)引入新的杂质离子Mn2+,生成Mn(OH)2
2Fe2++ClO-+2H+====2Fe3++Cl-+H2O
(3)稀硫酸 降温结晶 过滤 洗涤
(2)引入新的杂质离子Mn2+,生成Mn(OH)2
2Fe2++ClO-+2H+====2Fe3++Cl-+H2O
(3)稀硫酸 降温结晶 过滤 洗涤
(1)由表格中可以发现Fe3+沉淀完全时所需的pH较小,而Fe2+沉淀完全所需的pH较大,故加入氧化剂的目的就是将Fe2+氧化成Fe3+,便于沉淀,除杂。由表格可以看出Fe3+沉淀完全所需的pH为3.9,故pH要大于等于3.9,但不能让Cu2+沉淀,故pH要小于4.6(因Cu2+开始沉淀的pH的最小值为4.6,故答案为3.9≤pH<4.6。
(2)氧化剂若选用KMnO4,将引入新的杂质离子Mn2+,生成Mn(OH)2,在沉淀铜离子时,得不到纯净的Cu(OH)2;NaClO作为最佳氧化剂会将Fe2+氧化成Fe3+,本身被还原成Cl-,故正确答案为:2Fe2++ClO-+2H+====2Fe3++Cl-+H2O。
(3)先加入稀硫酸溶解氢氧化铜沉淀,然后蒸发浓缩,接着是降温结晶,析出晶体后,过滤,再洗涤,最后经干燥,得到成品
(2)氧化剂若选用KMnO4,将引入新的杂质离子Mn2+,生成Mn(OH)2,在沉淀铜离子时,得不到纯净的Cu(OH)2;NaClO作为最佳氧化剂会将Fe2+氧化成Fe3+,本身被还原成Cl-,故正确答案为:2Fe2++ClO-+2H+====2Fe3++Cl-+H2O。
(3)先加入稀硫酸溶解氢氧化铜沉淀,然后蒸发浓缩,接着是降温结晶,析出晶体后,过滤,再洗涤,最后经干燥,得到成品

练习册系列答案
 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案
相关题目
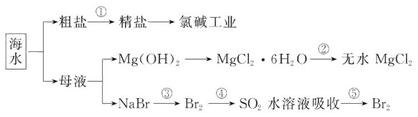
 、Ca2+、Mg2+、Fe3+等杂质,加入的药品顺序为:Na2CO3溶液→NaOH溶液→BaCl2溶液→过滤后加盐酸
、Ca2+、Mg2+、Fe3+等杂质,加入的药品顺序为:Na2CO3溶液→NaOH溶液→BaCl2溶液→过滤后加盐酸

 溶液A
溶液A

 莫尔盐
莫尔盐
