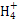题目内容
有一瓶无色气体可能含有CO2、HBr、NO2、HCl、SO2中的一种或几种。将此气体通入足量稀氯水中,恰好完全反应,得无色透明溶液,把此溶液分成两份,分别加入盐酸酸化了的BaCl2溶液和硝酸酸化了的AgNO3溶液,均出现白色沉淀,以下结论正确的是( )
| A.不能确定原气体中是否含有SO2 |
| B.原气体中肯定有HCl |
| C.原气体中肯定没有CO2 |
| D.原气体中肯定没有HBr、NO2 |
D
无色气体中一定不含有NO2;气体与氯水反应后得无色透明溶液,气体中一定不含HBr;加入盐酸酸化了的BaCl2溶液和硝酸酸化了的AgNO3溶液,均出现白色沉淀,说明溶液中含有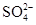 和Cl-,证明气体中一定含SO2,SO2+Cl2+2H2O=2HCl+H2SO4,则原气体中不一定含有HCl;没有现象证明CO2是否存在,A、B、C错误,D正确。
和Cl-,证明气体中一定含SO2,SO2+Cl2+2H2O=2HCl+H2SO4,则原气体中不一定含有HCl;没有现象证明CO2是否存在,A、B、C错误,D正确。
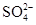 和Cl-,证明气体中一定含SO2,SO2+Cl2+2H2O=2HCl+H2SO4,则原气体中不一定含有HCl;没有现象证明CO2是否存在,A、B、C错误,D正确。
和Cl-,证明气体中一定含SO2,SO2+Cl2+2H2O=2HCl+H2SO4,则原气体中不一定含有HCl;没有现象证明CO2是否存在,A、B、C错误,D正确。
练习册系列答案
 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案
相关题目
 Cu(OH)2+H2↑
Cu(OH)2+H2↑ Fe(SCN)3+3KCl溶液平衡体系中加入少量固体KCl
Fe(SCN)3+3KCl溶液平衡体系中加入少量固体KCl