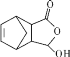
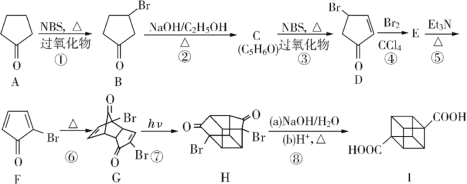题目内容
【题目】二甲醚是一种清洁能源,用水煤气制取甲醚的原理如下:
(ⅰ)2H2(g)+CO(g)![]() CH3OH(g) ΔH1
CH3OH(g) ΔH1
(ⅱ)2CH3OH(g)![]() CH3OCH3(g)+H2O(g) ΔH2
CH3OCH3(g)+H2O(g) ΔH2
(1)则4H2(g)+2CO(g)![]() CH3OCH3(g)+H2O(g)的ΔH=___(用含ΔH1、ΔH2的式子表示)
CH3OCH3(g)+H2O(g)的ΔH=___(用含ΔH1、ΔH2的式子表示)
(2)在恒容密闭容器中发生反应(ⅰ),
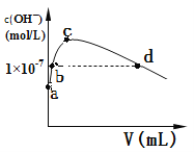
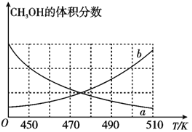
(Ⅰ)如图能正确反映平衡体系中甲醇体积分数随温度变化情况的曲线是__(填“a”或“b”);
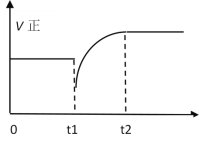
(Ⅱ)下列说法能表明反应(ⅰ)已达平衡状态的是__;
a.容器中气体的压强不再变化 b.混合气体的密度不再变化
c.混合气体的平均相对分子质量不再变化 d.v正(H2)=2v正(CH3OH)
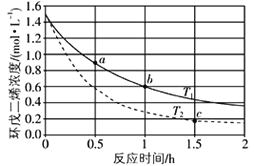
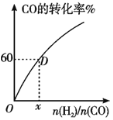
(Ⅲ)300℃下,CO的转化率与起始投料比![]() 的变化关系如图所示,测得D点氢气的转化率为40%,x=__。
的变化关系如图所示,测得D点氢气的转化率为40%,x=__。
【答案】2ΔH1+ΔH2 a ac 3
【解析】
(1)已知(ⅰ)2H2(g)+CO(g)![]() CH3OH(g);(ⅱ)CH3OH(g)
CH3OH(g);(ⅱ)CH3OH(g)![]() CH3OCH3(g)+H2O(g),(ⅰ)×2+(ⅱ)即得反应4H2(g)+2CO(g)
CH3OCH3(g)+H2O(g),(ⅰ)×2+(ⅱ)即得反应4H2(g)+2CO(g)![]() CH3OCH3(g)+H2O(g),其ΔH=2ΔH1+ΔH2;
CH3OCH3(g)+H2O(g),其ΔH=2ΔH1+ΔH2;
(2)(Ⅰ)反应(i)是化合反应,ΔH<0,温度升高,平衡逆向移动,甲醇体积分数减小,故选a;
(Ⅱ)a.该反应是反应后体积有变化的反应,根据阿伏伽德罗定律,压强和气体总的物质的量成正比,所以当容器中气体的压强不再变化达到平衡状态;
b.混合气体的总质量不变,容器体积不变,所以混合气的密度一直不变,所以密度不再变化不能判断反应是否平衡;
c.混合气体的总质量不变,但混合气的总的物质的量是变化的,所以混合气体的平均相对分子质量不再变化时达到了平衡状态;
d.v正(H2)=2v正(CH3OH)表示的都是正反应速率,无法确定反应是否平衡;
故选ac;
(Ⅲ)设起始投入CO的物质的量为1mol,则H2的物质的量为y mol,平衡时CO的转化率为60%,则反应的CO为0.6mol,根据方程式,同时反应的氢气为1.2mol,氢气的转化率为40%,所以![]() ×100%=40%,解得y=3,则x=
×100%=40%,解得y=3,则x=![]() =
=![]() =3。
=3。

 智慧小复习系列答案
智慧小复习系列答案【题目】硫铁矿石(主要成分FeS2)用于工业制硫酸,其排出的矿渣在一定条件下以磁性氧化铁为主。经磁选获得精矿,可直接用于高炉炼铁。已知某精矿的主要成分是磁性氧化铁( Fe3O4)和Fe2O3及杂质(杂质不含铁、硫、氧元素,且杂质不耗氧)。请回答下列问题:
(1)某硫铁矿石中(杂质不含铁、硫)含硫的质量分数是0.360,则该硫铁矿石中含铁元素的质量分数是________(答案用小数表示,保留3位小数)。
(2)如用上述硫铁矿石制硫酸,矿渣经磁选获得精矿,直接用于高炉炼铁,当制得98.0%的硫酸1.92吨时(不考虑硫的损失),则炼铁厂(不计选矿及炼铁时铁的损耗)最多可生产含碳4.00%的生铁____吨(答案保留3位小数)。
(3)煅烧硫铁矿常用富氧空气。从沸腾炉排出的气体成分如下表。如果精矿中铁、氧的物质的量之比为n (Fe):n(O)=5:7,则富氧空气中O2和N2的体积比(最简单的整数比)为_________。
气体 | SO2 | N2 | O2 |
物质的量 | 10 | 58 | 6 |
(4)炼铁厂生产的生铁常用于炼钢。取某钢样粉末28.12g(假设只含Fe和C),在氧气流中充分反应,得到CO2气体224mL(标准状况下)。
①计算此钢样粉末中铁和碳的物质的量之比为________(最简单的整数比)。
②再取三份不同质量的上述钢样粉末分别加到100mL相同浓度的稀H2SO4中,充分反应后,测得的实验数据如下表所示:
实验序号 | I | II | III |
加入钢样粉末的质量(g) | 2.812 | 5.624 | 8.436 |
生成气体的体积(L)(标准状况) | 1.120 | 2.240 | 2.800 |
则该硫酸溶液的物质的量浓度为________________。
③若在上述实验II中继续加入m g钢样粉末,计算反应结束后剩余的固体质量为多少?(写出必要的步骤,答案保留3位小数)_______________。