题目内容
【题目】已知,常温下CH3COOH和NH3·H2O的电离常数均为1.8×10-5。某小组进行如图三组实验且实验II、III中Mg(OH)2固体均溶解。下列说法正确的是

A.I中现象说明NH3·H2O碱性强于Mg(OH)2
B.II中总反应为2H++Mg(OH)2=Mg2++2H2O
C.实验II、III研究NH4+对Mg(OH)2溶解的作用原理
D.III中CH3COONH4浓度越小,越有利于沉淀的溶解
【答案】C
【解析】
A项、NH3·H2O为弱碱,Mg(OH)2为中强碱,NH3·H2O碱性弱于Mg(OH)2,故A正确;
B项、Mg(OH)2能够溶于呈酸性的氯化铵溶液和呈中性的醋酸铵溶液,说明NH4+结合Mg(OH)2电离出的OH-,使Mg(OH)2的溶解平衡正向移动,II中总反应为2NH4++Mg(OH)2=Mg2++2NH3·H2O,故B错误;
C项、实验II、III中Mg(OH)2能够溶于呈酸性的氯化铵溶液和呈中性的醋酸铵溶液,说明Mg(OH)2溶解不是与氢离子发生反应,反应原理是NH4+结合Mg(OH)2电离出的OH-,使Mg(OH)2的溶解平衡正向移动,导致Mg(OH)2溶解,故C正确;
D项、CH3COONH4溶液浓度越大,溶液中铵根离子浓度越大,越有利于Mg(OH)2沉淀的溶解,故D错误;
故选C。

 名校课堂系列答案
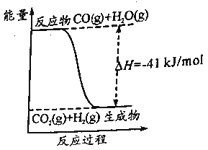
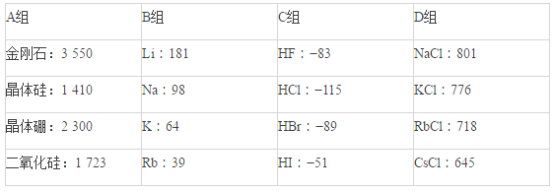
名校课堂系列答案【题目】CO2的回收与利用是科学家研究的热点课题,可利用CH4与CO2制备“合成气”(CO、H2),还可制备甲醇、二甲醚、低碳烯烃等燃料产品。
I.制合成气
科学家提出制备“合成气”反应历程分两步:
反应①:CH4(g)![]() C(ads)+2H2 (g) (慢反应)
C(ads)+2H2 (g) (慢反应)
反应②:C(ads)+ CO2(g)![]() 2CO(g) (快反应)
2CO(g) (快反应)
上述反应中C(ads)为吸附性活性炭,反应历程的能量变化如图:
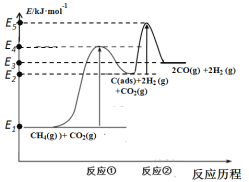
(1)CH4与CO2制备“合成气”的热化学方程式为_________。能量变化图中:E5+E1_________E4+E2(填“>”、“<”或“=”)。
II.脱水制醚
利用“合成气”合成甲醇后,甲醇脱水制得二甲醚的反应为:
2CH3OH(g)![]() CH3OCH3(g) + H2O(g) ΔH,其速率方程式为:v正= k正·c2(CH3OH),v逆=k逆·c(CH3OCH3)·c(H2O),k正、k逆为速率常数且只与温度有关。经查阅资料,上述反应平衡状态下存在计算式:lnKc = 2.205+
CH3OCH3(g) + H2O(g) ΔH,其速率方程式为:v正= k正·c2(CH3OH),v逆=k逆·c(CH3OCH3)·c(H2O),k正、k逆为速率常数且只与温度有关。经查阅资料,上述反应平衡状态下存在计算式:lnKc = 2.205+![]() (Kc为化学平衡常数;T 为热力学温度,单位为K)。
(Kc为化学平衡常数;T 为热力学温度,单位为K)。
(2)反应达到平衡后,仅升高温度,k正增大的倍数_________ k逆增大的倍数(填“>”、“<”或“=”)。
(3)某温度下(该反应平衡常数Kc为200),在密闭容器中加入一定量 CH3OH,反应到某时刻测得各组分的物质的量如下:
物质 | CH3OH | CH3OCH3 | H2O |
物质的量/mol | 0.4 | 0.4 | 0.4 |
此时正、逆反应速率的大小:v正 ____v逆 (填“>”、 “<”或“=”)。
(4)500K下,在密闭容器中加入一定量甲醇 CH3OH,反应到达平衡状态时,体系中CH3OCH3(g)的物质的量分数为_________(填标号)。
A <![]() B
B ![]() C >
C >![]() D 无法确定
D 无法确定