题目内容
13.工业上用铝土矿(主要成分是Al2O3以及少量Fe2O3、SiO2等)提取纯Al2O3作冶炼铝的原料.提取的操作过程可用以下流程图表示: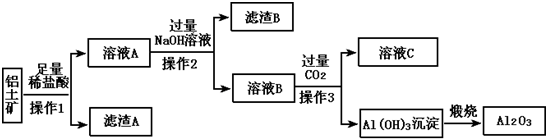
(1)操作1的名称是过滤,所需要的主要玻璃仪器除了漏斗、烧杯外还有玻璃棒.
(2)滤渣B的主要成分是SiO2(写化学式).
(3)写出溶液B通入过量CO2产生沉淀的化学方程式NaOH+CO2=NaHCO3、NaAlO2+CO2+2H2O=NaHCO3+Al(OH)3;该步骤中不能(填“能”或“不能”)改用盐酸代替通入CO2,原因是盐酸为强酸,能与氢氧化铝反应.
(4)若提取的过程中省略了操作1,将对所得的最后产品(Al2O3)产生的影响是Al2O3中有二氧化硅.
(5)电解熔融的氧化铝可制备金属铝:2Al2O3$\frac{\underline{\;通电\;}}{\;}$4Al+3O2↑.若生成4.48L(标准状况)的氧气,则该反应转移的电子数为1.2NA.
分析 根据题中流程可知,铝土矿的主要成分是Al2O3,还含有Fe2O3、SiO2等杂质,向铝土矿中加入足量盐酸,经过滤得滤渣A为SiO2和溶液A,所以操作Ⅰ为过滤,向溶液A中加入过量NaOH溶液得到滤渣B和溶液B,则溶液A中溶质为铁盐和铝盐,溶液B为NaAlO2和NaOH的溶液,滤渣B为Fe(OH)3,溶液B的溶质为NaAlO2和NaOH,向溶液B中通入气体过量CO2,NaAlO2、NaOH和CO2反应生成碳酸氢钠和Al(OH)3沉淀,所以溶液C为碳酸氢钠溶液,氢氧化铝煅烧得氧化铝,据此分析解答
解答 解:根据题中流程可知,铝土矿的主要成分是Al2O3,还含有Fe2O3、SiO2等杂质,向铝土矿中加入足量盐酸,经过滤得滤渣A为SiO2和溶液A,所以操作Ⅰ为过滤,向溶液A中加入过量NaOH溶液得到滤渣B和溶液B,则溶液A中溶质为铁盐和铝盐,溶液B为NaAlO2和NaOH的溶液,滤渣B为Fe(OH)3,溶液B的溶质为NaAlO2和NaOH,向溶液B中通入气体过量CO2,NaAlO2、NaOH和CO2反应生成碳酸氢钠和Al(OH)3沉淀,所以溶液C为碳酸氢钠溶液,氢氧化铝煅烧得氧化铝,
(1)根据上面的分析可知,操作1的名称是过滤,所需要的主要玻璃仪器除了漏斗、烧杯、玻璃棒,
故答案为:过滤;玻璃棒;
(2)根据上面的分析可知,滤渣B的主要成分是SiO2,
故答案为:SiO2;
(3)溶液B为NaAlO2和NaOH的溶液,溶液B通入过量CO2生成碳酸氢钠和Al(OH)3沉淀,反应的化学方程式为NaOH+CO2=NaHCO3、NaAlO2+CO2+2H2O=NaHCO3+Al(OH)3,盐酸为强酸,能与氢氧化铝反应,所以该步骤中不能改用盐酸代替通入CO2,
故答案为:NaOH+CO2=NaHCO3、NaAlO2+CO2+2H2O=NaHCO3+Al(OH)3;不能;盐酸为强酸,能与氢氧化铝反应;
(4)若提取的过程中省略了操作1,将对所得的最后产品(Al2O3)中会有二氧化硅的存在,
故答案为:Al2O3中有二氧化硅;
(5)根据方程式2Al2O3$\frac{\underline{\;通电\;}}{\;}$4Al+3O2↑可知,每生成1mol氧气电子转移6mol,所以若生成4.48L(标准状况)即0.2mol的氧气,转移的电子数为1.2NA,
故答案为:1.2NA.
点评 本题考查混合物的分离和提纯,明确物质性质是解本题关键,知道流程图中各步发生的反应、分离和提纯方法,会正确书写化学方程式,题目难度中等.

| A. | ${\;}_{92}^{235}$U原子核中含有92个中子 | |
| B. | ${\;}_{92}^{235}$U原子核外有143个电子 | |
| C. | ${\;}_{92}^{235}$U与${\;}_{92}^{238}$U互为同位素 | |
| D. | ${\;}_{92}^{235}$U与${\;}_{92}^{238}$U互为同素异形体 |
| A. | 明矾[KAl(SO4)2•12H2O]在水中能形成Al(OH)3胶体,可用作消毒剂和净水剂 | |
| B. | 在食品袋中放入盛有硅胶、生石灰的透气小袋,可防止食物受潮 | |
| C. | “雾霾天气”、“温室效应”、“光化学烟雾”的形成都与氮氧化物有关 | |
| D. | 食用植物油的重要成分是高级不饱和脂肪酸甘油酯,是天然高分子化合物 |
| A. | 酸性:HClO4>HBrO4>HIO4 碱性:NaOH>KOH>RbOH | |
| B. | 原子半径:Na>O>F 离子半径:Na+>O2->F- | |
| C. | 稳定性:HF>H2O>H2S 还原性:HCl<H2S<PH3 | |
| D. | 还原性:Na>Mg>Al 氧化性:P>S>Cl2 |
| A. | 3 mol/L HCl | B. | 4 mol/L HNO3 | C. | 8 mol/L NaOH | D. | 18 mol/L H2SO4 |
| A. | H2与T2互为同位素 | B. | 氯化钠、硫酸钡都属于强电解质 | ||
| C. | 离子化合物中可能含共价键 | D. | SO2、CO均属于酸性氧化物 |
①久置于空气中的氢氧化钠溶液,加盐酸时有气体产生 ②浓硫酸可用于干燥氢气、碘化氢等气体,但不能干燥氨气、二氧化氮气体 ③Na2O2与水反应,红热的Fe与水蒸气反应均能生成碱 ④玻璃、水泥、水晶项链都是硅酸盐制品 ⑤浓硫酸与铜反应既体现了其强氧化性又体现了其酸性 ⑥氢氧化铁胶体与氯化铁溶液分别蒸干灼烧得到相同的物质.
| A. | ①④⑤ | B. | ①⑤⑥ | C. | ②③④ | D. | ④⑤⑥ |
| 混合物 | 试剂 | 分离方法 | |
| ① | 苯(苯酚) | 氢氧化钠溶液 | 分液 |
| ② | 甲烷(乙烯) | 酸性高锰酸钾溶液 | 洗气 |
| ③ | 乙酸乙酯(乙酸) | 氢氧化钠溶液 | 蒸馏 |
| ④ | 乙炔(硫化氢) | 硫酸铜 | 洗气 |
| A. | ②③④ | B. | ②③ | C. | ③④ | D. | ③ |
