题目内容
【题目】将12.8g两种金属的混合物投入足量的盐酸中,反应完全后得到氢气11.2L(标准状况),该混合物的组成可能是( )
A.钙和锌B.镁和铜C.铝和镁D.钠和铁
【答案】B
【解析】
标况下11.2L氢气物质的量为![]() =0.5mol,假设金属均为+2价,金属总物质的量等于氢气物质的量,故混合金属平均摩尔质量为
=0.5mol,假设金属均为+2价,金属总物质的量等于氢气物质的量,故混合金属平均摩尔质量为![]() =25.6g/mol,因为两种金属的混合物,故平均摩尔质量应介于各组分之间,据此分析作答。
=25.6g/mol,因为两种金属的混合物,故平均摩尔质量应介于各组分之间,据此分析作答。
根据上述分析可知,
A.Ca摩尔质量为40g/mol,锌的摩尔质量为65g/mol,二者的平均摩尔质量大于25.6g/mol,不符合题意,A项不选;
B.Mg的摩尔质量为24g/mol,Cu不与盐酸反应,其摩尔质量可以视作无穷大,符合题意,B项选;
C.Al为+2价时的摩尔质量为27g/mol×![]() =18g/mol,Mg的摩尔质量为24g/mol,二者的摩尔质量都小于25.6g/mol,C项不选;
=18g/mol,Mg的摩尔质量为24g/mol,二者的摩尔质量都小于25.6g/mol,C项不选;
D.钠转化为+2价金属时的摩尔质量为46g/mol,Fe的摩尔质量为56g/mol,二者摩尔质量都大于25.6g/mol,不符合题意,D项不选;
答案选B。

练习册系列答案
相关题目
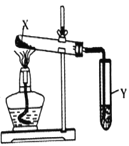
【题目】按图装置进行实验,下列现象能推断出结论的是( )
选项 | 试剂X | Y中试剂及现象 | 结论 | 装置 |
A | 一种盐 | 酚酞溶液未变红 | 该盐不可能是铵盐 |
|
B | 小苏打和纯碱 | 石灰水变浑浊 | 纯碱比小苏打稳定 | |
C | 氢氧化钙与氯化铵 | 硝酸银溶液中先产生沉淀后溶解 | Ag2O能溶于氨水 | |
D | 氯酸钾与二氧化锰 | 淀粉、碘化钾和和硫酸的混合溶液变蓝 | 反应产生了Cl2 |
A. A B. B C. C D. D