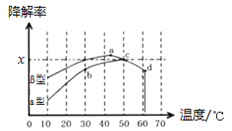
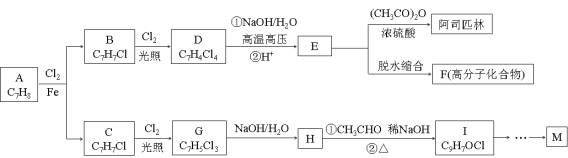
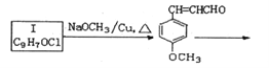
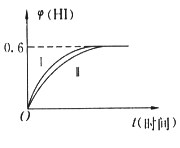
题目内容
【题目】化学平衡移动原理同样也适用于其他平衡,已知在氨水中存在下列平衡:NH3+H2O![]() NH3·H2O
NH3·H2O![]() NH4++OH-。
NH4++OH-。
(1)向氨水中加入MgCl2的固体时,平衡_________移动(填向左、向右或不),OH-的浓度________,(填变大、变小或不变,下同)NH4+的浓度_________。
(2)向氨水中加入浓盐酸,平衡__________移动(填向左、向右或不),此时溶液中浓度减小的微粒有________________。(至少填两种)
(3)向浓氨水中加入少量CaO固体,平衡___________移动(填向左、向右或不),此时发生的现象是______________________________________。
【答案】 向右 变小 变大 向右 OH-、NH3 、NH3·H2O (任填两种都给2分,少填或错填不给分) 向左 有无色刺激性气味的气体产生
【解析】①向氨水中加入氯化镁固体时,镁离子和氢氧根离子反应生成氢氧化镁沉淀,氢氧根离子浓度减小,促进一水合氨电离,平衡向右移动,则溶液中铵根离子浓度增大;
(2)向氨水中加入浓盐酸时,氢离子会消耗氢氧根离子,氢氧根离子浓度减小,一水合氨的电离平衡向右移动,NH3、NH3H2O的浓度均减小;
(3)向浓氨水中加入少量CaO固体,CaO溶解于水放热,同时生成Ca(OH)2导致溶液中氢氧根离子浓度增大,平衡向左移动,氢氧根离子和铵根离子反应生成氨气,所以有刺激性气体逸出。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】碘及其化合物在科研、生活等方面有广泛用途。回答下列问题:
(1)海带中富含碘,按如下实验流程可对海带中碘的含量进行测定。

取0.0100 mol/L的AgNO3标准溶液装入棕色滴定管,取100.00 mL海带浸取原液至滴定池,用电势滴定法测定碘含量。测得的电动势(E) 反映溶液中c(Iˉ)的变化,部分数据如下表:
V(AgNO3)/mL | 15.00 | 19.00 | 19.80 | 19.98 | 20.00 | 20.02 | 21.00 | 23.00 | 25.00 |
E/mV | -225 | -200 | -150 | -100 | 50.0 | 175 | 275 | 300 | 325 |
①灼烧海带时,除需要坩埚外,还需要用到的实验仪器是____________ (填序号)。
a.烧杯 b.三脚架 c.温度计 d.泥三角 e.酒精灯 f.坩埚钳
②使用棕色滴定管的原因是_____________________。
③根据表中数据,计算海带中碘的百分含量为____________。
(2)“大象的牙膏”是著名化学实验之一,其实验方法是将浓缩的过氧化氢溶液与肥皂液混合,再滴加少量碘化钾溶液,即可观察到泡沫状物质像喷泉一样喷涌而出。
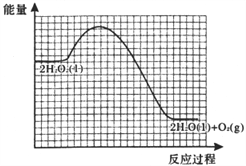
已知:2H2O2(l)=2H2O(l)+O2(g) △H=-196kJ/mol,活化能Ea=76kJ/mol,若用I-催化时活化能Ea’=57kJ/mol。
①在H2O2溶液中加入KI溶液作催化剂,反应过程中发生I-与IO-之间的转化,请依次写出发生反应的离子方程式:
反应甲:______________________;
反应乙:______________________。
②反应甲为吸热反应,且甲的反应速率小于乙的反应速率,在下图中画出在H2O2溶液中加入KI后,反应过程的能量变化图。_______
(3)HI不稳定,其水溶液具有强酸性。现用0.lmol/LKI溶液、NH4I固体、pH试纸设计实验验证上述性质。简述实验方案。
①强酸性:__________________________。
②不稳定性:___________________________。