题目内容
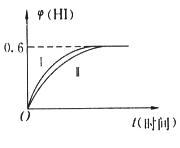
【题目】将1molI2(g)和2molH2(g)置于某2L密闭容器中,在一定温度下发生反应:I2(g)+H2(g) ![]() 2HI(g) △H<0,并在10min时达到平衡。HI的体积分数
2HI(g) △H<0,并在10min时达到平衡。HI的体积分数![]() (HI)随时间变化如图所示曲线(Ⅱ)。
(HI)随时间变化如图所示曲线(Ⅱ)。
(1)在此条件下,下列能说明该反应达到平衡状态的是___________(填序号)。
A.混合气体密度不再变化
B.反应混合物中H2的浓度不变
C.混合气体的颜色不再变化
D.每消耗1molH2同时消耗1molI2
(2)在达平衡过程中用HI(g)表示的反应速率为___________;I2(g)的平衡转化率为_______________。
(3)在此温度下,该反应的平衡常数K=_______(保留一位小数),若保持温度、体积不变,向已平衡的体系中再充入I2(g)和HI(g)各1mol,此时平衡___________(填“向左移动”“向右移动”或“不移动”)。
(4)若改变反应条件,在某条件下![]() (HI)的变化如曲线(Ⅰ)所示,则该条件可能是____________(填序号)。
(HI)的变化如曲线(Ⅰ)所示,则该条件可能是____________(填序号)。
①恒容条件下,降低温度
②恒温条件下,缩小反应容器体积
③恒温条件下,扩大反应容器体积
④恒温、恒容条件下,加入适当催化剂
(5)若保持温度不变,在另一相同的2L密闭容器中加入amolI2(g)、 bmolH2(g)和cmolHI(g)(a、b、c均大于0),发生反应达平衡时,HI体积分数仍为0.60,则a、b、c的关系为__________________(用一个含a、b、c的代数式表示)。
【答案】 B C 0.09 mol·L-1·min-1 90% K= 29.5 向右移动 ②④ 2(a+c/2)= (b+c/2)(其它合理答案也对)
【解析】(1)A.混合气体的质量和体积均不变,则混合气体密度始终不变,无法判断是否是平衡状态,故A错误;B.反应混合物中H2的浓度不变,量一定,是平衡状态,故B正确;C.混合气体的颜色不再变化,说明I2的浓度一定,是平衡状态,故C正确;D.每消耗1molH2同时消耗1molI2,均为正反应速率,无法判断是否是平衡状态,故D错误;答案为BC;
(2) I2(g)+H2(g) ![]() 2HI(g)
2HI(g)
起始物质的量(mol) 1 2 0
变化物质的量(mol) n n 2n
平衡物质的量(mol) 1 -n 2 -n 2n
![]() (HI)=
(HI)= ![]() ×100%=60%,解得:n=0.9mol,在达平衡过程中用HI(g)表示的反应速率为
×100%=60%,解得:n=0.9mol,在达平衡过程中用HI(g)表示的反应速率为 =0.09 mol·L-1·min-1 ;I2(g)的平衡转化率为
=0.09 mol·L-1·min-1 ;I2(g)的平衡转化率为![]() ×100%=90%;
×100%=90%;
(3)在此温度下,该反应的平衡常数K=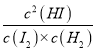 =
=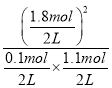 =29.5,Qc==
=29.5,Qc==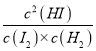 =
=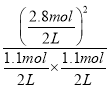 =6.48<29.5,则此时平衡向右移动;
=6.48<29.5,则此时平衡向右移动;
(4)在甲条件下![]() (HI)的变化如曲线(Ⅰ) 所示,反应时间缩短,碘化氢的含量不变,说明该条件只增大了反应速率不影响平衡,增大压强和加入催化剂对该反应平衡无影响,但都增大反应速率,缩短反应时间;故答案为②④;
(HI)的变化如曲线(Ⅰ) 所示,反应时间缩短,碘化氢的含量不变,说明该条件只增大了反应速率不影响平衡,增大压强和加入催化剂对该反应平衡无影响,但都增大反应速率,缩短反应时间;故答案为②④;
(5)若保持温度不变,在另一个相同的2L密闭容器中加入a mol I2(g)、b mol H2(g)和c mol HI(a、b、c均大于0),发生反应,达平衡时,HI的体积分数仍为0.6,与原来的平衡是等效平衡,恒温恒容,前后气体体积不变化,按化学计量数转化到左边,满足与原来加入的反应物物质的量比例相等即可;
对于反应 I2(g)+H2(g)![]() 2HI(g);
2HI(g);
开始(mol):a b c
变化(mol): ![]() c
c ![]() c c
c c
平衡(mol):a+![]() c b+
c b+![]() c 0
c 0
则(a+![]() c ):( b+
c ):( b+![]() c)=1∶2,所以4a+c=2b。
c)=1∶2,所以4a+c=2b。

 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案【题目】气体打火机使用的有机燃料,稍加压降温即可液化,减压(打开阀门)很容易汽化,遇明火燃烧,你认为符合这种条件的有机燃料是
A | B | C | D | |
化学式 | C2H6 | C3H6 | C4H10 | C5H12 |
沸点/℃ | -88.6 | -42.1 | -0.5 | 36.1 |
熔点/℃ | -183.3 | -189.7 | -138.4 | -129.7 |
A. AB. BC. CD. D