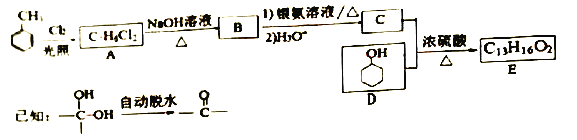
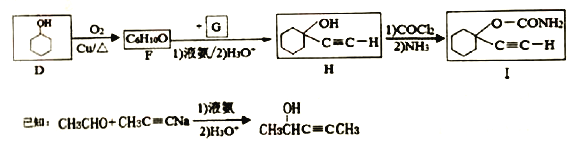
题目内容
【题目】用NA表示阿伏加德罗常数的值,下列说法中不正确的是()
A. 若由CO2和O2组成的混合物中共有NA个分子,则其中的氧原子数为2NA
B. 压强为1.01×105Pa时,48g O2和O3的混合物中含有的原子数为3NA
C. 常温下,8 g NH4NO3所含的氮原子数为0.1NA
D. 1.7 g H2O2中含有的电子数为0.9NA
【答案】C
【解析】
A、二氧化碳和氧气中均含2个氧原子,故NA个二氧化碳和氧气分子中含有的氧原子的个数为2NA个,故A正确;B、常温常压下,48g O3和O2含有氧原子物质的量为![]() =3mol,氧原子数为3NA,故B正确;C、常温下,8 g NH4NO3的物质的量为
=3mol,氧原子数为3NA,故B正确;C、常温下,8 g NH4NO3的物质的量为![]() =0.1mol,含有0.2molN原子,氮原子数为0.2NA,故C错误;D.1.7g双氧水的物质的量为0.05mol,0.05mol双氧水中含有0.9mol电子,含有的电子数为0.9NA,故D正确;故选C。
=0.1mol,含有0.2molN原子,氮原子数为0.2NA,故C错误;D.1.7g双氧水的物质的量为0.05mol,0.05mol双氧水中含有0.9mol电子,含有的电子数为0.9NA,故D正确;故选C。

【题目】目前工业上可利用CO或CO2来生产燃料甲醇,某研究小组对下列有关甲醇制取的三条化学反应原理进行了探究。己知在不同温度下的化学平衡常数(K1、K2、K3)如表所示。
化学反应 | 焓变 | 平衡常数 | 温度/℃ | ||
500 | 700 | 800 | |||
①2H2(g)+CO(g) | △H1 | K1 | 2.5 | 0.34 | 0.15 |
②CO2(g)+H2(g)CO(g)+H2O(g) | △H2 | K2 | 1.0 | 1.70 | 2.52 |
③CO2(g)+3H2(g)CH3OH(g)+H2O(g) | △H3 | K3 | |||
请回答下列问题:
(1)反应②是_______(填“吸热”或“放热”)反应。
(2)根据反应①与②可推导出K1、K2与K3之间的关系,则K3=_______(用K1、K2表示);根据反应③判断△S_______(填“>”“=”或“<”)0,在_______(填“较高”或“较低”)温度下有利于该反应自发进行。
(3)要使反应③在一定条件下建立的平衡逆向移动,可采取的措施有______(填字母,后同)。
A.缩小反应容器的容积 B.增大反应容器的容积
C.升高温度 D.使用合适的催化剂
E.从平衡体系中及时分离出CH3OH
(4)500℃时,测得反应③在某时刻,CO2(g)、H2(g)、CH3OH(g)、H2O(g的浓度分别为 0.1mol/L、0.8 mol/L、0.3 mol/L、0.15 mol/L,则此时v(正)_______v(逆) (填“>”“=”或“<”)。
(5)某兴趣小组研究反应②的逆反应速率在下列不同条件下随时间的变化曲线,开始时升高温度,t1时平衡,t2时减小压强,t3时增大CO的浓度,t4时又达到平衡。在下图中画出t2至t4的曲线。_____