题目内容
10.下列说法错误的是( )| A. | 镀锌铁板是利用了牺牲阳极的阴极保护法来达到防止腐蚀的目的 | |
| B. | 反应Hg(1)+H2SO4(aq)═HgSO4(aq)+H2(g)在常温下不能自发进行,则△H>0 | |
| C. | 将纯水加热至较高温度,Kw变大、pH变小、呈酸性 | |
| D. | 对于反应2H2O2═2H2O+O2↑,加入MnO2或升高温度都能加快O2的生成速率 |
分析 A.锌比铁活泼,形成原电池反应时锌为负极;
B.反应不能自发,应满足△G=△H-T•△S>0,结合反应的△H和△S进行判断;
C.纯水呈中性;
D.加入催化剂或升高温度,都可增大反应速率.
解答 解:A.锌比铁活泼,形成原电池反应时锌为负极,锌被氧化,铁被保护,为牺牲阳极的阴极保护法,故A正确;
B.反应不能自发,应满足△G=△H-T•△S>0,即△H>T•△S,而反应的△S>0,故△H>0,故B正确;
C.升高温度,Kw变大、pH变小,但氢离子和氢氧根离子浓度相等,纯水呈中性,故C错误;
D.加入催化剂或升高温度,都可增大活化分子百分数,增大反应速率,故D正确.
故选C.
点评 本题考查较综合,涉及弱电解质的电离、电解原理等知识点,明确物质的性质及反应原理是解本题关键,易错选项是C,题目难度中等.

练习册系列答案
相关题目
6.通过核裂变产生核能可以用于发电,${\;}_{92}^{235}$U是一种常用的核燃料,下列说法错误的是( )
| A. | U元素的近似相对原子质量为235 | |
| B. | ${\;}_{92}^{235}$U中中子数比质子数多51 | |
| C. | ${\;}_{92}^{235}$U与${\;}_{6}^{12}$C的质量比约为235:12 | |
| D. | ${\;}_{92}^{235}$U 与${\;}_{92}^{238}$U属于同一种元素 |
18.下列叙述正确的是( )
| A. | 浓氨水中滴加FeCl3饱和溶液可制得Fe(OH)3胶体 | |
| B. | 一定温度下,pH相同的①CH3COONa、②NaHCO3、③NaClO三种溶液的c(Na+):①>②>③ | |
| C. | CH3COONa溶液中滴加少量浓盐酸后c(CH3COO-)增大 | |
| D. | 25℃时Cu(OH)2在水中的溶解度大于其在Cu(NO3)2溶液中的溶解度 |
15.下列说法不正确的是( )
| A. | pH<7的雨水就是酸雨 | |
| B. | 绿色化学的核心就是利用化学原理从源头上减少和消除工业生产对环境的影响 | |
| C. | 含氮、磷的大量污水任意排放是导致水华的主要原因 | |
| D. | 垃圾是放错地方的资源,应该分类回收利用 |
2.有关化学用语正确的( )
| A. | 乙烯的结构简式:CH2CH2 | B. | NH4Cl的电子式: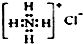 | ||
| C. | NH3的结构式为: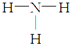 | D. | -CH3(甲基)的电子式为: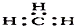 |
19.糖类、油脂和蛋白质是维持人体生命活动所必需的三大营养物质,以下叙述错误的是( )
| A. | 葡萄糖能发生氧化反应和水解反应 | |
| B. | 淀粉在稀酸催化下,最终水解为葡萄糖 | |
| C. | 蛋白质在酶催化下可水解成氨基酸 | |
| D. | 油脂在碱性条件下的水解反应又叫皂化反应 |
20.在恒容绝热条件下,一定能说明反应A(g)+B(?)═2C(g)已达到平衡状态的是( )
| A. | 容器内的密度不再变化 | |
| B. | C的生成速率与A的分解速率之比为2:1 | |
| C. | 混合物的平均摩尔质量不再变化 | |
| D. | 容器内的温度不再发生变化 |
 ;
; .
. .
.