题目内容
5.在2SO2+O2?2SO3的反应里,开始SO2和O2的浓度均为0.5mol•L-1,2分钟后测得SO2的浓度为0.25mol•L-1,则v(O2)=0.0625mol•L-1•min-1,各物质所表示的反应速率的最简整数比v(SO2):v(SO3):v(O2)=2:2:1.分析 2分钟后测得SO2的浓度为0.25mol•L-1,则△c(SO2)=(0.5-0.25)mol/L=0.25mol/L,根据v=$\frac{△c}{△t}$计算二氧化硫的平均反应速率,再根据同一可逆反应同一时间段内各物质的反应速率之比等于其计量数之比计算氧气反应速率,从而确定v(SO2):v(SO3):v(O2)的值.
解答 解:2分钟后测得SO2的浓度为0.25mol•L-1,则△c(SO2)=(0.5-0.25)mol/L=0.25mol/L,v(SO2)=$\frac{△c}{△t}$=$\frac{0.25}{2}$mol•L-1•min-1=0.125mol•L-1•min-1,同一可逆反应同一时间段内各物质的反应速率之比等于其计量数之比得氧气反应速率=$\frac{1}{2}$v(SO2)=$\frac{1}{2}$×0.125mol•L-1•min-1=0.0625 mol•L-1•min-1,同一可逆反应同一时间段内各物质的反应速率之比等于其计量数之比,所以v(SO2):v(SO3):v(O2)=2:2:1,
故答案为:0.0625 mol•L-1•min-1;2:2:1.
点评 本题考查化学反应速率的有关计算,明确反应速率之比与计量数之比关系是解本题关键,侧重考查学生计算能力,题目难度不大.

练习册系列答案
相关题目
13.下列反应中,一定不能自发进行的是( )
| A. | 2KClO3(s)═2KCl(s)+3O2(g);△H=-78.03kJ•mol-1:△S=494.4 J•mol-1•K-1 | |
| B. | CO(g)═C(s,石墨)+$\frac{1}{2}$O2(g);△H=110.5kJ•mol-1,△S=-89.4 J•mol-1•K-1 | |
| C. | 4Fe(OH)2(s)+2H2O(l)+O2(g)═4Fe(OH)3(s)△H=-444.3kJ•mol-1,△S=-280.1 J•mol-1•K-1 | |
| D. | NH4HCO3(s)+CH3COOH(aq)═CO2(g)+CH3COONH4(aq)+H2O(l);△H=37.30kJ•mol-1,△S=184.0 J•mol-1•K-1 |
10.下列说法错误的是( )
| A. | 镀锌铁板是利用了牺牲阳极的阴极保护法来达到防止腐蚀的目的 | |
| B. | 反应Hg(1)+H2SO4(aq)═HgSO4(aq)+H2(g)在常温下不能自发进行,则△H>0 | |
| C. | 将纯水加热至较高温度,Kw变大、pH变小、呈酸性 | |
| D. | 对于反应2H2O2═2H2O+O2↑,加入MnO2或升高温度都能加快O2的生成速率 |
17.下列说法正确的是( )
| A. | 碱金属单质的密度随着原子序数的增大而增大 | |
| B. | 碱金属单质都是银白色金属 | |
| C. | 在周期表中金属与非金属的分界处,可以找到半导体材料 | |
| D. | 所有气体单质都含有非极性键 |
15.空气冷却分离是工业上制取大量氮气的主要方法.已知空气各主要成分的沸点如表:
若将空气深度冷却液化,然后缓慢升温,沸腾分离,则最先分离出来的气体是( )
| 气体 | N2 | O2 | Ar | CO2 |
| 沸点 | -196℃ | -183℃ | -186℃ | -78℃ |
| A. | O2 | B. | N2 | C. | Ar | D. | CO2 |
 ;
;
 .
. 与
与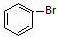 也可以发生类似反应①的反应,有机产物的结构简式为:
也可以发生类似反应①的反应,有机产物的结构简式为: .
.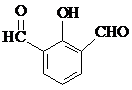 、
、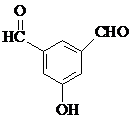 、
、