题目内容
【题目】请回答下列问题:
![]() 已知:
已知:![]() 、
、![]() 分子中化学键的键能分别是
分子中化学键的键能分别是![]() 、
、![]()
![]()
![]()
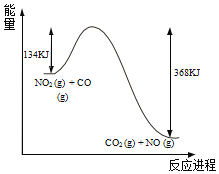
则相同条件下破坏1molNO中化学键需要吸收的能量为______kJ。
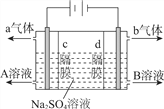
![]() 如图所示,U形管内盛有100mL的溶液,
如图所示,U形管内盛有100mL的溶液,
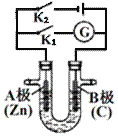
![]() 断开
断开![]() ,闭合
,闭合![]() ,若所盛溶液为
,若所盛溶液为![]() 溶液:则A为______极。若所盛溶液为KCl溶液:
溶液:则A为______极。若所盛溶液为KCl溶液:![]() 移向______极
移向______极![]() 填“A”、“B”
填“A”、“B”![]()
![]() 断开
断开![]() ,闭合
,闭合![]() ,若所盛溶液为滴有酚酞的NaCl溶液,则:A电极附近可观察到的现象是______。反应一段时间后打开
,若所盛溶液为滴有酚酞的NaCl溶液,则:A电极附近可观察到的现象是______。反应一段时间后打开![]() ,若要使电解质溶液恢复到原状态,需向U形管内加入或通入一定量的______。
,若要使电解质溶液恢复到原状态,需向U形管内加入或通入一定量的______。
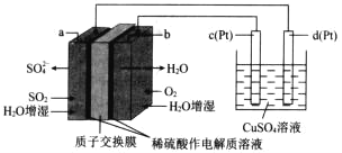
![]() 若是电解精炼粗铜,断开
若是电解精炼粗铜,断开![]() ,闭合
,闭合![]() ,电解液选用
,电解液选用![]() 溶液,则A电极的材料应换成______,反应一段时间后电解质溶液中
溶液,则A电极的材料应换成______,反应一段时间后电解质溶液中![]() 浓度______
浓度______![]() 填“增大”、“减小”或“不变”
填“增大”、“减小”或“不变”![]()
【答案】![]() 正 B 产生无色气泡,溶液变红色 HCl 纯铜 减小
正 B 产生无色气泡,溶液变红色 HCl 纯铜 减小
【解析】
(1)断键吸收能量,成键放出能量,设NO的键能为x,![]() +
+![]() -2x=
-2x=![]() ,解得x=631.5 kJ·mol—1,破坏1molNO中化学键需要吸收的能量为631.5KJ
,解得x=631.5 kJ·mol—1,破坏1molNO中化学键需要吸收的能量为631.5KJ
(2)①原电池中,阴离子向负极移动,阳离子向正极移动,![]() 移向正极。
移向正极。
②断开![]() ,闭合
,闭合![]() ,该装置是电解池,A为阴极,B为阳极,所盛溶液为滴有酚酞的NaCl溶液,A级发生的反应:2H2O+2e—=2OH—+H2↑电解一段时间,导致碱性增强,酚酞变红,产生无色气泡;
,该装置是电解池,A为阴极,B为阳极,所盛溶液为滴有酚酞的NaCl溶液,A级发生的反应:2H2O+2e—=2OH—+H2↑电解一段时间,导致碱性增强,酚酞变红,产生无色气泡;
反应一段时间后打开![]() ,若要使电解质溶液恢复到原状态,根据“析出什么就加入什么”的原则,分析方程式:
,若要使电解质溶液恢复到原状态,根据“析出什么就加入什么”的原则,分析方程式: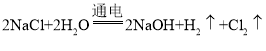 ,反应放出H2和Cl2,相当于析出HCl,所以通入HCl。
,反应放出H2和Cl2,相当于析出HCl,所以通入HCl。
③A级是阴级,B级是阳级,电解精炼粗铜粗铜在阳极,精铜在阴极,A电极的材料应换成纯铜。
(3)用电荷守恒就可以因为阳极上存在的杂质也发生了电极反应,而阴极上只有铜析出,溶解的铜小于析出的铜。换言之,进入溶液的Cu2+少于阴极消耗的Cu2+,所以c(Cu2+)减小。