题目内容
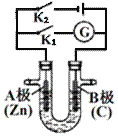
【题目】传统接触法制取硫酸能耗大,污染严重。将燃料电池引入 硫酸生产工艺可有效解决能耗和环境污染问题,同时提供电能 以燃料电池为电源电解硫酸铜溶液的工作原理示意图如下所示。下列说法不正确的是( )
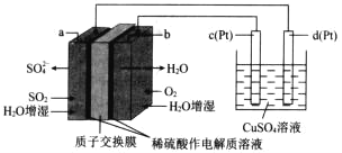
A.若 a 极消耗 2.24LSO2,理论上 c 极有 6.4g 铜析出
B.H+由 a 极通过质子交换膜向 b 极移动
C.该燃料电池的总反应式为 2SO2+O2+2H2O=2H2SO4
D.b 极为正极,电极反应式为 O2+4H++4e-=2H2O
【答案】A
【解析】
A.a是燃料电池的负极,d是电解池的阴极,标准状况下22.4LSO2的物质的量为0.1mol,若a电极消耗0.1molSO2,转移0.2mol电子,理论上在d电极析出0.1molCu,这些铜的质量为6.4g,但题目没有给出标准状况,无法计算,故A符合题意;
B.原电池工作时,阳离子移向正极,所以,上述燃料电池工作时,H+由a极通过质子交换膜向b极移动,故B不符合题意;
C.该燃料电池的还原剂是SO2,氧化剂是O2,氧化产物是H2SO4,电池总反应为:2SO2+O2+2H2O=2H2SO4,故C不符合题意;
D.b电极的反应物是氧气,b是燃料电池的正极,由于介质是稀硫酸,正极的电极反应式为:O2+4H++4e-=2H2O,故D不符合题意;
故答案为:A。

【题目】工业上用含三价钒(V2O3)为主的某石煤为原料(含有 Al2O3、CaO 等杂质),钙化法焙烧制备 V2O5,其流程如下:
![]()
(资料)+5 价钒在溶液中的主要存在形式与溶液 pH 的关系:
pH | 4~6 | 6~8 | 8~10 | 10~12 |
主要离子 | VO2+ | VO3- | V2O74- | VO43- |
(1)焙烧: 向石煤中加生石灰焙烧,将 V2O3 转化为 Ca(VO3)2 的化学方程式是______________。
(2)酸浸:①Ca(VO3)2 难溶于水,可溶于盐酸。若焙砂酸浸时溶液的 pH=4,Ca(VO3)2 溶于盐酸的离子方程式是________。
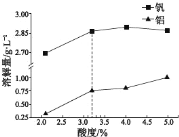
②酸度对钒和铝的溶解量的影响如图所示:酸浸时溶液的酸度控制在大约 3.2%,根据下图推测,酸浸时不选择更高酸度的原因是________________。
(3)转沉: 将浸出液中的钒转化为 NH4VO3 固体,其流程如下:
![]()
①浸出液中加入石灰乳的作用是_____。
②向(NH4)3VO4 溶液中加入 NH4Cl 溶液,控制溶液的 pH=7.5。当 pH>8 时,NH4VO3 的产量明显降低,原因是_______________。
(4)测定产品中 V2O5 的纯度:称取 ag 产品,先用硫酸溶解,得到(VO2)2SO4 溶液。再加入 b1mLc1mol/L(NH4)2Fe(SO4)2 溶液(VO2++2H++Fe2+=VO2++Fe3++H2O) 最后用 c2mol/LKMnO4 溶液滴定过量的(NH4)2Fe(SO4)2 至终点,消耗 KMnO4 溶液的体积为 b2mL。已知 MnO4-被还原为 Mn2+,假设杂质不参与反应。则产品中 V2O5 的质量分数是_____。(V2O5 的摩尔质量::182g/mol)