题目内容
【题目】第三周期元素X、Y、Z、W的最高价氧化物溶于水可得四种溶液,0.010mol/L的这四种溶液pH与该元素原子半径的关系如下图所示。下列说法正确的是
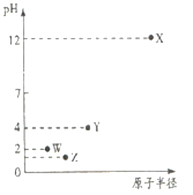
A. 简单离子半径:X>Y>Z>W
B. Z元素形成的单质存在同素异形体
C. 气态氢化物的稳定性:Z>W>Y
D. X和Y的最高价氧化物对应的水化物恰好中和时,溶液呈中性
【答案】B
【解析】
四种溶液的物质的量浓度为0.010mol·L-1,根据图像,W对应溶液的pH=2,说明W对应溶液为一元强酸,元素位于第三周期,即W为Cl,X对应溶液的pH=12,则X对应溶液为一元强碱,即X为Na,Z对应水溶液的pH<1,即Z为二元强酸,即Z为S,Y对应的水溶液为酸性,由于H2SiO3难溶于水,故Y为只能P;
四种溶液的物质的量浓度为0.010mol·L-1,根据图像,W对应溶液的pH=2,说明W对应溶液为一元强酸,元素位于第三周期,即W为Cl,X对应溶液的pH=12,则X对应溶液为一元强碱,即X为Na,Z对应水溶液的pH<1,即Z为二元强酸,即Z为S,Y对应的水溶液为酸性,由于H2SiO3难溶于水,故Y只能为P,
A、离子半径大小顺序是P3->S2->Cl->Na+,故A错误;
B、Z为P,P单质有红磷、白磷等,红磷和白磷互为同素异形体,故B正确;
C、非金属性越强,其气态氢化物的稳定性越强,非金属性:Cl>S>P,即气态氢化物稳定性顺序是HCl>H2S>PH3,故C错误;
D、反应后生成Na3PO4,Na3PO4属于强碱弱酸盐,PO43-发生水解,溶液显碱性,故D错误。

 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案【题目】实验室中有一未知浓度的稀盐酸,某学生用0.10 mol·L-1 NaOH标准溶液进行测定盐酸的浓度的实验。取20.00 mL待测盐酸放入锥形瓶中,并滴加2~3滴酚酞作指示剂,用自己配制的NaOH标准溶液进行滴定。重复上述滴定操作2~3次,记录数据如下。完成下列填空:

实验编号 | 待测盐酸的体积(mL) | NaOH溶液的浓度(mol·L-1) | 滴定完成时,NaOH溶液滴入的体积(mL) |
1 | 20.00 | 0.10 | 24.18 |
2 | 20.00 | 0.10 | 23.06 |
3 | 20.00 | 0.10 | 22.96 |
I、(1)滴定达到终点的标志是是______________________。
(2)根据上述数据,可计算出该盐酸的浓度约为___________(保留小数点后3位)。
(3)排除碱式滴定管尖嘴中气泡的方法应采用________操作,然后轻轻挤压玻璃球使尖嘴部分充满碱液。
(4)在上述实验中,下列操作(其他操作正确)会造成测定结果偏高的有___________。
A.用酸式滴定管取20.00 mL待测盐酸,使用前,水洗后未用待测盐酸润洗
B.锥形瓶水洗后未干燥
C.称量NaOH固体时,有小部分NaOH潮解
D.滴定终点读数时俯视
E.碱式滴定管尖嘴部分有气泡,滴定后消失
II、硼酸(H3BO3)是生产其它硼化物的基本原料。
已知H3BO3的电离常数为5.8×10-10,H2CO3的电离常数为K1=4.4×10-7、K2=4.7×10-11。向盛有饱和硼酸溶液的试管中,滴加0.1 mol/LNa2CO3溶液,____________(填“能”或“不能”)观察到气泡逸出。已知H3BO3与足量NaOH溶液反应的离子方程式为H3BO3+OH-=B(OH)4-,写出硼酸在水溶液中的电离方程式_____________________。
Ⅲ、某温度时测得0.01 mol/L的NaOH溶液pH为11,求该温度下水的离子积常数KW =_________
(1)图I表示10mL量筒中液面的位置,A与B,B与C刻度间相差1mL,如果刻度A为4,量简中液体的体积是________mL。

(2)图II表示50mL滴定管中液面的位置,如果液面处的读数是a ,则滴定管中液体的体积(填代号)______________。
A. 是amL
B.是(50-a)mL
C. 一定大于amL
D.一定大于(50-a)mL