题目内容
【题目】如图是周期表的一部分,根据元素在周期表中位置回答下列问题:
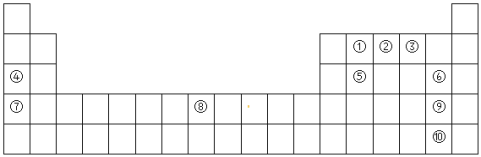
(1)元素⑤在周期表中的位置描述为_____________________,元素⑧的元素符号______。
(2)元素①~⑩的最高价氧化物的水化物中,碱性最强的是_____________(填化学式)。
(3)元素②的单质的电子式___________,元素②的简单氢化物与其最高价氧化物的水化物反应的生成物中含有的化学键______________________,元素①、②、③的简单氢化物的沸点由高到低的顺序是__________________________(用化学式表示)。
(4)非金属性比较:
a.装置1可用于比较元素①、②、⑤的非金属性强弱,则B中发生反应的离子方程式为______________
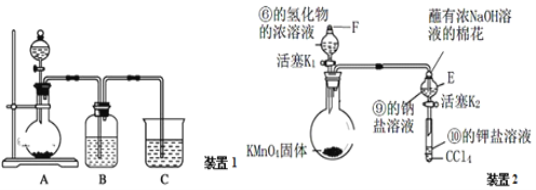
b.打开装置2中玻璃塞F和活塞K1,使液体滴入烧瓶中,待E中溶液颜色不再变化后,打开活塞K2,将E中溶液滴入小试管中,关闭活塞K2,取下小试管振荡,静置,下层液体呈现紫红色。上述实验______(填“能”或“不能”)证明非金属性⑥>⑨>⑩
【答案】第三周期第IVA族 Fe KOH ![]() 离子键和极性键 H2O>NH3>CH4 H++HCO3-=H2O+CO2
离子键和极性键 H2O>NH3>CH4 H++HCO3-=H2O+CO2![]() 不能
不能
【解析】
(1)根据元素在周期表中的位置推出各序号代表的元素;
(4)根据元素①、②、⑤分别为C,N,Si,利用最高价氧化物的水化物的酸性强弱比较非金属性,利用强酸制弱酸比较酸性强弱;高锰酸钾置换出氯气,氯气再置换出NaBr溶液中的Br2,Br2再置换出KI中的碘单质,从而比较其元素的非金属性。
(1)根据元素周期表推出元素⑤是Si,位置在第三周期的IVA族,元素⑧在第四周期第Ⅷ族,是Fe;
(2)根据元素周期律,同一周期从左往右金属性减弱,同一主族从上到下金属性增强,序号代表的元素中金属性最强的元素为⑦,元素K;其最高价氧化物的水化物碱性最强,为KOH;
(3)元素②是N,它的单质是N2,N最外层有5个电子,为达到稳定结构N原子间需要共用3对共用电子对,其电子式为![]() ;元素②的简单氢化物NH3,与其最高价氧化物的水化物HNO3,反应产物是NH4NO3,包含化学键是离子键和极性键;元素①是C,元素是②N,元素③是O,其简单氢化物分别为CH4、NH3、H2O,均为共价分子,沸点与分子间作用力有关,分子间作用力越大,沸点越高。首先,相对分子质量越大,分子间作用力越大,沸点越高,其次NH3和H2O存在氢键,沸点会升高,水分子的间氢键比氨气分子间的多而且强,CH4分子间无氢键,所以沸点从高到低H2O>NH3>CH4;
;元素②的简单氢化物NH3,与其最高价氧化物的水化物HNO3,反应产物是NH4NO3,包含化学键是离子键和极性键;元素①是C,元素是②N,元素③是O,其简单氢化物分别为CH4、NH3、H2O,均为共价分子,沸点与分子间作用力有关,分子间作用力越大,沸点越高。首先,相对分子质量越大,分子间作用力越大,沸点越高,其次NH3和H2O存在氢键,沸点会升高,水分子的间氢键比氨气分子间的多而且强,CH4分子间无氢键,所以沸点从高到低H2O>NH3>CH4;
(4)根据元素①、②、⑤分别为C,N,Si,利用强酸制弱酸的道理设计实验,所以A装置发生的是硝酸和碳酸钠的反应,生成的二氧化碳进入B,B是洗气装置,吸收A中挥发出来的硝酸,防止对后续的实验带来干扰,CO2进入C装置与硅酸钠反应,观察现象,以判断三者的非金属性强弱,所以B中的化学方程式为HNO3+NaHCO3=NaNO3+H2O+CO2![]() ,离子方程式为H++HCO3-=H2O+CO2
,离子方程式为H++HCO3-=H2O+CO2![]() ;氯气通入E中,直到溶液颜色不再发生改变,溶液中溶解了氯气,打开活塞K2,将E中溶液滴入小试管中,除了溴能置换出碘外,溶液中溶解的氯气以及氯气溶于溶液生成的次氯酸也能使KI变成碘单质,所以不能证明非金属性⑥>⑨>⑩。
;氯气通入E中,直到溶液颜色不再发生改变,溶液中溶解了氯气,打开活塞K2,将E中溶液滴入小试管中,除了溴能置换出碘外,溶液中溶解的氯气以及氯气溶于溶液生成的次氯酸也能使KI变成碘单质,所以不能证明非金属性⑥>⑨>⑩。

【题目】利用水钴矿(主要成分为Co2O3,含少量Fe2O3、Al2O3、MnO、MgO、CaO、SiO2等)可以制取多种化工试剂,以下为草酸钴晶体和氯化钴晶体的制备流程,回答下列问题:
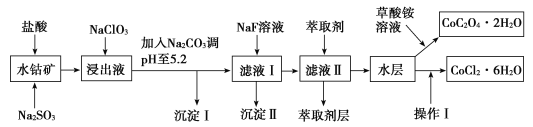
已知:①浸出液中含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+、Mg2+、Ca2+等。
②沉淀Ⅰ中只含有两种沉淀。
③流程中部分阳离子以氢氧化物形式沉淀时溶液的pH见表:
沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(1)浸出过程中加入Na2SO3目的是___。
(2)NaClO3在浸出液中发生反应的离子方程式为___。
(3)加入Na2CO3调pH至5.2,目的是___;萃取剂层含锰元素,则沉淀Ⅱ的主要成分为__。
(4)操作Ⅰ包括:将水层加入浓盐酸调整pH为2~3,___、__、过滤、洗涤、减压烘干等过程。
(5)为测定粗产品中CoCl2·6H2O的含量,称取一定质量的粗产品溶于水,加入足量硝酸酸化的硝酸银溶液,过滤、洗涤、干燥,测沉淀质量。通过计算发现粗产品中CoCl2·6H2O质量分数大于100%,其原因可能是___(回答一条原因即可)。
(6)将5.49g草酸钴晶体(CoC2O4·2H2O)置于空气中加热,受热过程中不同温度范围内分别得到一种固体物质,其质量如下表。
温度范围/℃ | 固体质量/g |
150~210 | 4.41 |
290~320 | 2.41 |
经测定,整个受热过程,只产生水蒸气和CO2气体,则290~320℃温度范围,剩余的固体物质化学式为____。[已知:CoC2O4·2H2O的摩尔质量为183g·mol1]
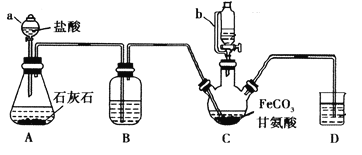
【题目】甘氨酸亚铁[(NH2CH2COO)2Fe]是一种补铁强化剂。某学习小组利用FeCO3与甘氨酸(NH2CH2COOH)制备甘氨酸亚铁,实验装置如下图所示(夹持和加热仪器已省略)。
有关物质性质如下表:
甘氨酸 | 柠檬酸 | 甘氨酸亚铁 |
易溶于水,微溶于乙醇 | 易溶于水和乙醇 | 易溶于水,难溶于乙醇 |
两性化合物 | 强酸性、强还原性 |
实验过程:
I.合成:装置C中盛有0.1mol FeCO3和200mL1.0mol·L-1甘氨酸溶液和适量柠檬酸。实验时,先打开仪器a的活塞,待装置c中空气排净后,加热并不断搅拌,并通过仪器b向C中加入适量氢氧化钠溶液调节pH到6左右,使反应物充分反应。
Ⅱ.分离:反应结束后,过滤,将滤液进行蒸发浓缩;加入无水乙醇,过滤、洗涤并干燥。
回答下列问题:
(1)仪器a的名称是________;与a相比,仪器b的优点是_____________________________。
(2)装置B中盛有的试剂是____________;实验过程中装置D的导管一直没入液面下的必要性是___________________________________________。
(3)合成过程加入柠檬酸的作用是促进FeCO3溶解和________________________ 。
(4)加入氢氧化钠溶液调节pH若大于6,甘氨酸亚铁产量下降。原因可用离子方程式表示为________。
(5)过程II中加入无水乙醇的目的是_______________________。
(6)检验产品中是否含有Fe3+的试剂名称是_________ 。
(7)本实验制得15.3g甘氨酸亚铁(M=204g/mol),则其产率是_____%。