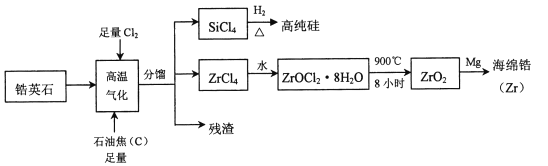
题目内容
【题目】氨基甲酸铵(![]() )是一种易分解、易水解的白色固体,可用于化肥、灭火剂、洗涤剂等。某化学兴趣小组模拟工业原理制备氨基甲酸铵。反应式:
)是一种易分解、易水解的白色固体,可用于化肥、灭火剂、洗涤剂等。某化学兴趣小组模拟工业原理制备氨基甲酸铵。反应式:![]() 。
。

(1)如果使用如图所示的装置制取![]() ,你所选择的试剂是__________________。
,你所选择的试剂是__________________。
(2)制备氨基甲酸铵的装置如图,把氨和二氧化碳通入四氯化碳中,不断搅拌混合,生成的氨基甲酸铵小晶体悬浮在四氯化碳中,当悬浮物较多时,停止制备。(注:四氯化碳与液体石蜡均为惰性介质。)
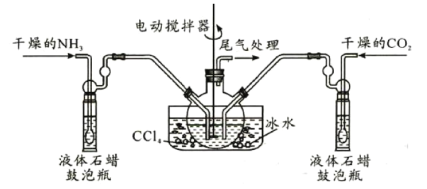
①发生器用冰水冷却的原因是________________________________________________;液体石蜡鼓泡瓶的作用是__________________________;发生反应的仪器名称是_______________。
②从反应后的混合物中过滤分离出产品。为了得到干燥产品,应采取的方法是_______________(选填序号)
a.常压加热烘干 b.高压加热烘干 c.真空40℃以下烘干
(3)尾气有污染,吸收处理所用试剂为浓硫酸,它的作用是_________________________。
(4)取因部分变质而混有碳酸氢铵的氨基甲酸铵样品![]() ,用足量石灰水充分处理后,使碳元素完全转化为碳酸钙,过滤、洗涤、干燥,测得质量为
,用足量石灰水充分处理后,使碳元素完全转化为碳酸钙,过滤、洗涤、干燥,测得质量为![]() 。样品中氨基甲酸铵的质量分数为_______________。[已知
。样品中氨基甲酸铵的质量分数为_______________。[已知![]() ]
]
【答案】浓氨水、氧化钙(氢氧化钠) 提高原料转化率、防止产物分解 控制气体的流速和原料气体的配比 三颈烧瓶 c 将氨气转化为固体盐 79.8%
【解析】
首先我们要用(1)中的装置来制取氨气,固液不加热制取氨气可以考虑将浓氨水滴入到固体氧化钙或氢氧化钠中,制好的氨气经干燥后通入液体石蜡鼓泡瓶,通过观察鼓泡瓶中气泡的大小,我们可以调节氨气和二氧化碳两种原料的比例,接下来在三颈烧瓶中进行反应;冰水浴的作用是降低温度,提高转化率,据此来分析作答即可。
(1)固液不加热制取氨气,可以将浓氨水滴入固体氧化钙或氢氧化钠或碱石灰中;
(2)①制备氨基甲酸铵的反应是放热反应,因此给发生器降温可以有效提高原料的转化率,并且防止生成物温度过高分解;而液体石蜡鼓泡瓶的作用是控制反应进行程度,控制气体流速和原料气体的配比;发生仪器的名称为三颈烧瓶;
②为了防止产品受热分解以及被氧化,应选用真空40℃以下烘干,c项正确;
(3)尾气中的氨气会污染环境,因此可以用硫酸吸收将其转化为固体盐,可用作氮肥;
(4)首先根据![]() 算出碳酸钙的物质的量,设碳酸氢铵的物质的量为xmol,氨基甲酸铵的物质的量为ymol,则根据碳守恒有
算出碳酸钙的物质的量,设碳酸氢铵的物质的量为xmol,氨基甲酸铵的物质的量为ymol,则根据碳守恒有![]() ,根据质量守恒有
,根据质量守恒有![]() ,联立二式解得
,联立二式解得![]() ,
,![]() ,则氨基甲酸铵的质量分数为
,则氨基甲酸铵的质量分数为![]() 。
。

 阅读快车系列答案
阅读快车系列答案【题目】碱式氧化(NiOOH)可用废镍催化剂(主要含Ni、Al,少量Cr、FeS等)来制备,其工艺流程如下:
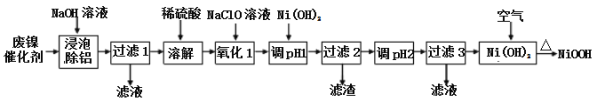
回答下列问题:
(1)“浸泡除铝”时,发生反应的离子反应方程式为_____________________。
(2)“过滤1”用到的玻璃仪器________________________________________。
(3)已知该条件下金属离子开始沉淀和完全沉淀的pH如下表:
开始沉淀的pH | 完全沉淀的pH | |
Ni2+ | 6.2 | 8.6 |
Fe2+ | 7.6 | 9.1 |
Fe3+ | 2.3 | 3.3 |
Cr3+ | 4.5 | 5.6 |
“调pH 1”时,溶液pH范围为_______________;
(4)在空气中加热Ni(OH)2可得NiOOH,请写出此反应的化学方程式________________。
(5)在酸性溶液中CrO![]() 可以转化成Cr2O
可以转化成Cr2O![]() ,用离子方程式表示该转化反应__________,已知BaCrO4的Ksp=1.2×10-10,要使溶液中CrO
,用离子方程式表示该转化反应__________,已知BaCrO4的Ksp=1.2×10-10,要使溶液中CrO![]() 沉淀完全(c(CrO
沉淀完全(c(CrO![]() )≦1×10-5mol·L1),溶液中钡离子浓度至少为________mol·L1。
)≦1×10-5mol·L1),溶液中钡离子浓度至少为________mol·L1。
【题目】二氯化二硫(S2Cl2)是一种重要的化工原料,常用作橡胶硫化剂,改变生橡胶受热发粘、遇冷变硬的性质。查阅资料可知S2Cl2具有下列性质:
物理性质 | 毒性 | 色态 | 挥发性 | 熔点 | 沸点 |
剧毒 | 金黄色液体 | 易挥发 | -76℃ | 138℃ | |
化学性质 | ①300℃以上完全分解; ②S2Cl2+Cl2 ③遇高热或与明火接触,有引起燃烧的危险; ④受热或遇水分解放热,放出腐蚀性烟气; | ||||
Ⅰ.制取少量S2Cl2
实验室可利用硫与少量氯气在110~140℃反应制得S2Cl2粗品。
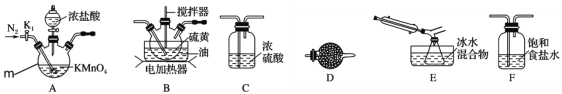
(1)仪器m的名称为___,装置A中发生反应的离子方程式为 ______________。
(2)装置连接顺序:A→___→___→___→E→D。______________
(3)为了提高S2Cl2的纯度,实验的关键是控制好温度和__________________。
(4)若D中所装试剂为碱石灰,则该装置的作用为______________。
II.测定产品中SO2Cl2的含量,实验步骤如下:
①取1.8g产品加入足量Ba(OH)2溶液,充分振荡、过滤、洗涤,将所得溶液均放入锥形瓶中;
②向锥形瓶中加入硝酸酸化,再加入0.2000mol·L-1的AgNO3溶液l00.00mL;
③向其中加入2mL硝基苯,用力摇动,使沉淀表面被有机物覆盖;
④加入NH4Fe(SO4)2指示剂,用0.1000mol·L-1NH4SCN溶液滴定过量Ag+,终点所用体积为10.00mL。
已知:Ksp(AgCl)=3.2×10-10 ;Ksp(AgSCN)=2×10-12
(5)滴定终点的现象为_____________________________。
(6)产品中SO2Cl2的质量分数为__________,若步骤③不加入硝基苯则所测SO2Cl2含量将________(填“偏高”、“偏低”或“无影响”)。