题目内容
【题目】二氯化二硫(S2Cl2)是一种重要的化工原料,常用作橡胶硫化剂,改变生橡胶受热发粘、遇冷变硬的性质。查阅资料可知S2Cl2具有下列性质:
物理性质 | 毒性 | 色态 | 挥发性 | 熔点 | 沸点 |
剧毒 | 金黄色液体 | 易挥发 | -76℃ | 138℃ | |
化学性质 | ①300℃以上完全分解; ②S2Cl2+Cl2 ③遇高热或与明火接触,有引起燃烧的危险; ④受热或遇水分解放热,放出腐蚀性烟气; | ||||
Ⅰ.制取少量S2Cl2
实验室可利用硫与少量氯气在110~140℃反应制得S2Cl2粗品。
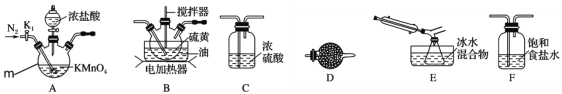
(1)仪器m的名称为___,装置A中发生反应的离子方程式为 ______________。
(2)装置连接顺序:A→___→___→___→E→D。______________
(3)为了提高S2Cl2的纯度,实验的关键是控制好温度和__________________。
(4)若D中所装试剂为碱石灰,则该装置的作用为______________。
II.测定产品中SO2Cl2的含量,实验步骤如下:
①取1.8g产品加入足量Ba(OH)2溶液,充分振荡、过滤、洗涤,将所得溶液均放入锥形瓶中;
②向锥形瓶中加入硝酸酸化,再加入0.2000mol·L-1的AgNO3溶液l00.00mL;
③向其中加入2mL硝基苯,用力摇动,使沉淀表面被有机物覆盖;
④加入NH4Fe(SO4)2指示剂,用0.1000mol·L-1NH4SCN溶液滴定过量Ag+,终点所用体积为10.00mL。
已知:Ksp(AgCl)=3.2×10-10 ;Ksp(AgSCN)=2×10-12
(5)滴定终点的现象为_____________________________。
(6)产品中SO2Cl2的质量分数为__________,若步骤③不加入硝基苯则所测SO2Cl2含量将________(填“偏高”、“偏低”或“无影响”)。
【答案】三颈烧瓶 2MnO4-+10Cl-+16H+=5Cl2↑+2Mn2++8H2O FCB 滴入浓盐酸的速率(或B中通入氯气的量) 防止空气中的水蒸气进入E中,吸收多余的氯气 溶液变为红色,而且半分钟内不褪色 71.25% 偏低
【解析】
(1)根据仪器m的形状可知其为三颈烧瓶;装置A为利用高锰酸钾氧化浓盐酸生成氯气的装备,该过程中高锰酸根被还原,氯离子被氧化生成氯气,离子方程式为:2MnO4-+10Cl-+16H+=5Cl2↑+2Mn2++8H2O;
(2)本实验需要用硫与少量氯气在 110~140℃反应制备S2Cl2 粗品,根据题目信息“熔点-76℃,沸点138℃”,制备的产品为气体,需要冷凝收集;受热或遇水分解放热,所以温度要控制好,同时还要在无水环境进行制备,则氯气需要干燥除杂,且制备装置前后都需要干燥装置,且氯气有毒需要进行尾气处理;所以装置连接顺序为A、F、C、B、E、D;
(3)反应中氯气过量则会生成SCl2,温度过高S2Cl2会分解,为了提高S2Cl2的纯度,实验的关键是控制好温度和滴入浓盐酸的速率或B中通入氯气的量;
(4)根据分析可知该装置的作用为防止空气中的水蒸气进入E中,同时吸收多余的氯气;
(5)SO2C12加入足量Ba(OH)2溶液,溶液中含有氯离子,加入硝酸酸化硝酸银生成AgCl沉淀,过量的硝酸银与NH4SCN溶液反应生成AgSCN沉淀,滴定终点银离子完全反应,SCN-与铁离子发生显色反应,滴定终点溶液呈红色,所以现象为:溶液变为红色,而且半分钟内不褪色;
(6)加入0.2000molL-1的AgNO3溶液l00.00 mL,则n(AgNO3)=0.02000mol,用0.1000molL-1 NH4SCN溶液滴定过量Ag+,终点所用体积为10.00mL,则n(AgSCN)=0.001mol,则n(SO2Cl2)=![]() ×(0.02000mol-0.001mol)=0.0095mol,所以产率为
×(0.02000mol-0.001mol)=0.0095mol,所以产率为![]() =71.25%;根据题目信息Ksp(AgCl)=3.2×10-10 ,Ksp(AgSCN)=2×10-12,AgSCN更容易沉淀,若不加入硝基苯,部分AgCl转化为AgSCN沉淀,造成测定结果偏低。
=71.25%;根据题目信息Ksp(AgCl)=3.2×10-10 ,Ksp(AgSCN)=2×10-12,AgSCN更容易沉淀,若不加入硝基苯,部分AgCl转化为AgSCN沉淀,造成测定结果偏低。