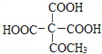题目内容
【题目】已知A、B、C、D、E、F、G为前四周期中的常见元素,且原子序数依次增大,A的原子半径最小;B的基态原子L层电子数是K层电子数的2倍;C的基态原子最外层电子排布式为nsmnpm+2;D、E、F、G是位于同一周期的金属元素,元素D的焰色反应要透过蓝色钴玻璃才能观察到紫色,且D、G的原子序数相差10,E元素有多种化合价。它的一种氢氧化物在空气中易被氧化且最终变为红褐色,且E.、F的电子数相差1。
请回答下列问题:
(1)基态E原子的价电子排布式为_________________。
(2)与BC分子互为等电子体的离子为______________________(填化学式)。
(3)在B5A5、BC2中,B原子采取的杂化方式分別为____________、_____________。
(4)单质C有两种同素异形体,其中沸点高的是__________(填分子式),而它的简单氢化物的沸点比同主族的简单氢化物都高的原因是___________________。
(5)F可形成分子式均为F(NH3)5BrSO4的两种配合物,其中一种化学式为[F(NH3)5Br]SO4。向其溶液中加BaCl2溶液时,现象为_____________;向另一种配合物的溶液中加入BaCl2溶液时,无明显现象。若加入AgNO3溶液时,产生淡黄色沉淀,则第二种配合物的化学式为__________________。
(6)金属D、G晶体的晶胞结构如图所示。


①其中表示金属D晶体晶胞的结构图为__________(填“I”或“II”)。
②金属G的晶胞中,测得晶胞边长为361 pm,G 原子的半径约为_________pm(保留三位有效数字),D、G两种晶胞中金属的配位数之比为_______________。
③金属G、锌两种元素的笫一电离能、第二电离能如下表所示:
电离能/kJ mol-1 | I1 | I2 |
G | 746 | 1958 |
锌 | 906 | 1733 |
G的第二电离能(I2)大于锌的第二电离能,其主要原因是______________。
【答案】 3d44s2 CN-(或NO+或![]() C
C![]() ) sp2 sp O3 水分子间存在氢键 产生白色沉淀 [Co(NH8)6SO4]Br I 128 2:3 锌的价电子是3d104s2,而铜的是3d104s1,在失去一个电子后,铜失去的第二个电子在3d的全满轨道上,而锌的第二个电子在4s的半满轨道上,3d全满比4s半满能量低,结构也更稳定,所以需要更多能量
) sp2 sp O3 水分子间存在氢键 产生白色沉淀 [Co(NH8)6SO4]Br I 128 2:3 锌的价电子是3d104s2,而铜的是3d104s1,在失去一个电子后,铜失去的第二个电子在3d的全满轨道上,而锌的第二个电子在4s的半满轨道上,3d全满比4s半满能量低,结构也更稳定,所以需要更多能量
【解析】试题分析:A的原子半径最小,A是H元素;B的基态原子L层电子数是K层电子数的2倍,B是碳元素;C的基态原子最外层电子排布式为nsmnpm+2,n=2,则C是O元素;D、E、F、G是位于同一周期的金属元素,元素D的焰色反应要透过蓝色钴玻璃才能观察到紫色,D是K元素;且D、G的原子序数相差10,G是Cu元素;E的一种氢氧化物在空气中易被氧化且最终变为红褐色,E是Fe元素; E.、F的电子数相差1,F是Co元素。
解析:根据以上分析,(1)基态26号元素Fe的价电子排布式为3d64s2。
(2)与CO分子互为等电子体的离子为CN-。
(3)在C5H5、CO2直线结构,C原子采取的杂化方式分別为SP2、SP。
(4)单质O有两种同素异形体O2、O3,O3比O2相对分子质量大所以沸点高,水分子间形成氢键,所以沸点比同主族的简单氢化物都高。
(5) Co可形成分子式均为Co (NH3)5BrSO4的两种配合物,其中一种化学式为[Co(NH3)5Br]SO4,硫酸根离子在外界,溶于水能电离出硫酸根离子,所以向其溶液中加BaCl2溶液时,现象为生成白色沉淀;向另一种配合物的溶液中加入BaCl2溶液时,无明显现象。若加入AgNO3溶液时,产生淡黄色沉淀,说明硫酸根在内界,溴离子在外界,则第二种配合物的化学式为[Co(NH8)6SO4]Br。
(6)金属D、G晶体的晶胞结构如图所示。
①金属K是体心立方最密堆积,晶体晶胞的结构图为I。
②金属Cu的晶胞为面心立方,测得晶胞边长为361 pm,面对角线的为![]() ,G 原子的半径约为
,G 原子的半径约为![]() 128pm,金属K的配位数是8、计算Cu的配位数是12,配位数比是2:3。
128pm,金属K的配位数是8、计算Cu的配位数是12,配位数比是2:3。
③锌的价电子是3d104s2,而铜的是3d104s1,在失去一个电子后,铜失去的第二个电子在3d的全满轨道上,而锌的第二个电子在4s的半满轨道上,3d全满比4s半满能量低,结构也更稳定,所以需要更多能量所以Cu的第二电离能(I2)大于锌的第二电离能。

【题目】氯酸钾在工业上具有广泛的应用,某研究性学习小组利用如图所示的实验装置制备氯酸钾。回答下列问题:
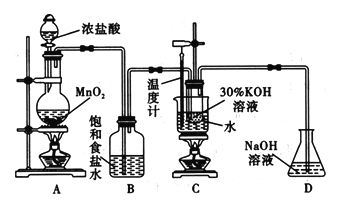
(1)写出装置C中发生反应的离子方程式:_______________________。
(2)若无B装置,则装置C中氯酸钾的产率将___________ (填“提高” “降低”或“无影响”)。
(3)在不同条件下KC1O3可将KI氧化为I2或KIO3。该小组设计了系列实验研究体系中硫酸浓度对反应产物的影响,实验的记录表如下表(实验在室温下进行):
试管编号 | 1 | 2 | 3 | 4 |
0. 20mol L-1KI/mL | V1 | 1.0 | 1.0 | 1.0 |
KC1O3(s)/g | 0.10 | 0.10 | 0.10 | 0.10 |
6.0mol L-1H2SO4/mL | 0 | 3.0 | V2 | 9.0 |
蒸馏水 | 9.0 | V3 | 3.0 | 0 |
实验现象 |
①实验设计表中V1=____________; V2 =_____________; V3 =_______________。
②设计1号试管实验的作用是_________________。
③若2号试管实验现象为“黄色溶液”,取少量该溶液加入淀粉溶液显蓝色;假设氧化产物唯一,还原产物为KCl,则此反应的离子方程式为__________________。
(4)工业上可用KC1O3与Na2SO3在H2SO4存在下制备高效、低毒的消毒剂C1O2,该反应的化学方程式为______________________ ;利用该反应原理,若工业上使用122.5吨KClO3与足量的Na2SO3反应,生成的ClO2用于除去工业废水中的Mn2+,可得到MnO2固体165吨,则该反应的产率约为___________。