��Ŀ����
����Ŀ��������ڹ�ҵ�Ͼ��й㷺��Ӧ�ã�ij�о���ѧϰС��������ͼ��ʾ��ʵ��װ���Ʊ�����ء��ش��������⣺
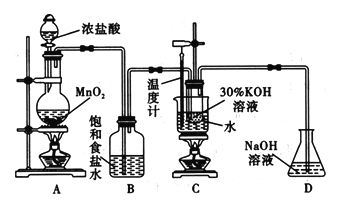
(1)д��װ��C�з�����Ӧ�����ӷ���ʽ��_______________________��
(2)����Bװ�ã���װ��C������صIJ��ʽ�___________ (���ߡ� �����͡�����Ӱ�족����
(3)�ڲ�ͬ������KC1O3�ɽ�KI����ΪI2��KIO3����С�������ϵ��ʵ���о���ϵ������Ũ�ȶԷ�Ӧ�����Ӱ�죬ʵ��ļ�¼�����±���ʵ���������½��У���
�Թܱ�� | 1 | 2 | 3 | 4 |
0. 20mol L-1KI/mL | V1 | 1.0 | 1.0 | 1.0 |
KC1O3(s)/g | 0.10 | 0.10 | 0.10 | 0.10 |
6.0mol L-1H2SO4/mL | 0 | 3.0 | V2 | 9.0 |
����ˮ | 9.0 | V3 | 3.0 | 0 |
ʵ������ |
��ʵ����Ʊ���V1=____________�� V2 =_____________�� V3 =_______________��
�����1���Թ�ʵ���������_________________��
����2���Թ�ʵ������Ϊ����ɫ��Һ����ȡ��������Һ���������Һ����ɫ��������������Ψһ����ԭ����ΪKCl����˷�Ӧ�����ӷ���ʽΪ__________________��
(4)��ҵ�Ͽ���KC1O3��Na2SO3��H2SO4�������Ʊ���Ч���Ͷ���������C1O2���÷�Ӧ�Ļ�ѧ����ʽΪ______________________ �����ø÷�Ӧԭ��������ҵ��ʹ��122.5��KClO3��������Na2SO3��Ӧ�����ɵ�ClO2���ڳ�ȥ��ҵ��ˮ�е�Mn2+���ɵõ�MnO2����165�֣���÷�Ӧ�IJ���ԼΪ___________��
���𰸡� ![]() =
= ![]() ���� 1.0 6.0 6.0 ����Ũ��Ϊ0�Ŀհ���ʵ��
���� 1.0 6.0 6.0 ����Ũ��Ϊ0�Ŀհ���ʵ�� ![]() =
= ![]() 2KClO3 + Na2SO3 + H2SO4=2ClO2 + K2SO4 + Na2SO4 + H2O 76%
2KClO3 + Na2SO3 + H2SO4=2ClO2 + K2SO4 + Na2SO4 + H2O 76%
��������(1)װ��C�Ʊ�����أ����з�����Ӧ�����ӷ���ʽΪ3Cl2+6OH����ClO3��+3H2O+5Cl����(2)���ɵ������к����Ȼ��⣬�Ȼ�����������������Һ��Ӧ������ʳ��ˮ��ȥ�Ȼ��⣬����Bװ�ã���װ��C������صIJ��ʽ����͡�(3)��Ҫ�о�����Ũ�ȶԷ�Ӧ�����Ӱ�죬��Ҫ��������������ͬ��ֻ�ı������Ũ�ȣ���V1=1.0��V2 =6.0��V3 =6.0����1���Թ���û�м����ᣬʵ�������������Ũ��Ϊ0�Ŀհ���ʵ�顣����2���Թ�ʵ������Ϊ����ɫ��Һ����ȡ��������Һ���������Һ����ɫ��˵���е������������������Ψһ����ԭ����ΪKCl����˷�Ӧ�����ӷ���ʽΪClO3��+6H++6I����3I2+Cl��+3H2O��(4)��ҵ�Ͽ���KC1O3��Na2SO3��H2SO4�������Ʊ���Ч���Ͷ���������C1O2������ԭ���غ�͵��ӵ�ʧ�غ��֪���������ơ�����غ�ˮ���ɣ��÷�Ӧ�Ļ�ѧ����ʽΪ2KClO3 + Na2SO3 + H2SO4=2ClO2 + K2SO4 + Na2SO4 + H2O�����ݵ��ӵ�ʧ�غ��֪�����Ͽɵõ��������̵�������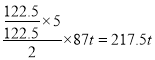 ��������÷�Ӧ�IJ���ԼΪ
��������÷�Ӧ�IJ���ԼΪ![]() ��
��





