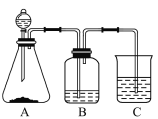
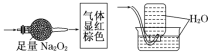
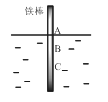
题目内容
【题目】氢、氮、氧、硫,镁,铁、铜,锌等元素及其化合物在人们的日常生活中有着广泛的用途。回答下列问题:
(1)某同学根据已学知识,推断Mg基态原子的核外电子排布为,
![]()
该同学所画的电子排布图违背了________________________________.
(2)Fe位于___________族_______区,Fe2+价电子排布式为_____________。
(3)MgCO3的分解温度____ BaCO3 (填“>” 或、“<”)
(4)C、N、O元素的第一电离能由大到小的顺序为_________________
(5)1mol[Cu(NH3)2]+中含有σ键的数目为___________
(6)下列有关说法不正确的是____。
A.热稳定性:NH3 >PH3,原因是NH3分子间存在氢键,而PH3分子间存在范德华力
B.SO2与CO2的化学性质有些类似,但空间结构与杂化方式不同
C.熔、沸点: SiF4< SiCl4< SiBr4 <SiI4 , 原因是分子中共价键键能逐渐增大
D.熔点: CaO > KCl > KBr,原因是晶格能逐渐减小
(7)晶体Cu的堆积方式如图所示,其中Cu原子在二维平面里放置时的配位数为_________,设Cu原子半径为a,晶体的空间利用率为______。(用含π,a、的式子表示,不必化简)

【答案】泡利原理 第Ⅷ族 d 3d6 < N>O>C 8 mol(或8×6.02×1023) AC 6 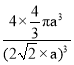 ×100%或者
×100%或者![]() ×100%
×100%
【解析】
(1)泡利原理:一个原子轨道上最多可容纳两个电子,而这两个电子的自旋方向必须相反;
(2)铁是26号元素,据此解答;铁原子在失电子时,先失去最外层的两个4s电子。
(3)为同主族元素的离子,从上到下,离子半径逐渐增大,半径越大,分解温度越高,越不易分解,相反,阳离子半径越小,越容易分解;
(4)同一周期元素,第一电离能随着原子序数增大而呈增大趋势,但第IIA族、第VA族元素第一电离能大于其相邻元素;
(5)单键均为σ键,双键中有1个σ键和一个π键,配位键也属于σ键;
(7)铜原子在二维平面里放置为密致层,晶体空间利用率为![]() ×100%。
×100%。
(1)如图所示的电子排布图中3s轨道有两个自旋方向一样的电子,违反了泡利原理,
故答案为:泡利原理;
(2)Fe位于第Ⅷ族族d区,铁原子核外电子排布式为:1s22s22p63s23p63d64s2,去4s能级2个电子形成Fe2+,可知Fe2+基态核外电子排布式为1s22s22p63s23p63d6,Fe2+的价电子排布式为:3d6,
故答案为:第Ⅷ族;d; 3d6;
(3)为同主族元素的离子,从上到下,离子半径逐渐增大,半径越大,分解温度越高,越不易分解,相反,阳离子半径越小,越容易分解,镁与钡同主族,所以BaCO3比MgCO3分解温度高,
故答案为:<;
(4)同一周期元素,第一电离能随着原子序数增大而呈增大趋势,但第IIA族、第VA族元素第一电离能大于其相邻元素;
故答案为:N>O>C
(5)1个[Cu(NH3)2]+中6个N—H单键,2个配位键,所以1mol[Cu(NH3)2]+中含有σ键的数目为8 mol(或8×6.02×1023),
故答案为:8 mol(或8×6.02×1023);
(6)A.热稳定性:NH3 >PH3,原因是氮氢键比磷氢键键能更大,故A错误;
B.SO2与CO2的化学性质有些类似,SO2为sp2杂化,平面三角形,CO2的为sp杂化,直线型,故B正确;
C.SiF4、SiCl4、SiBr4、SiI4都是分子晶体,影响熔、沸点高低的因素是分子间作用力或氢键,不是化学键影响。故C错误;
D.CaO、KCl、KBr都是离子晶体,影响熔、沸点高低的主要因素离子键,离子键强弱用晶格能来衡量,离子键越强晶格能越大。CaO的阴阳离子半径小、所带电荷多,所以离子键最强,晶格能最大;KBr的阴阳离子半径大、所带电荷少,所以离子键最弱,晶格能最小,故D正确,
故答案为:AC;
(7)铜原子在二维平面里放置为密致层,故配位数为6;设Cu原子半径为a,每个面对角线上的三个Cu原子紧密相连,所以晶胞棱长=2![]() a,晶胞体积=(2
a,晶胞体积=(2![]() a)3,该晶胞中Cu原子个数8×1/8+6×1/2=4。晶体空间利用率为
a)3,该晶胞中Cu原子个数8×1/8+6×1/2=4。晶体空间利用率为![]() ×100%=
×100%=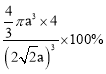 ,
,
故答案为:6;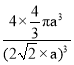 ×100%或者
×100%或者![]() ×100%。
×100%。

 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案【题目】某无色稀溶液X中,可能含有下表所列离子中的某几种。
阴离子 | CO |
阳离子 | Al3+、Fe3+、Mg2+、NH4+、Na+ |
现取该溶液适量,向其中加入某试剂Y,产生沉淀的物质的量(n)与加入试剂Y体积(V)的关系如图所示,下列说法正确的是( )
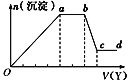
A.若Y是盐酸,则Oa段转化为沉淀的离子(上表中,下同)只有[Al(OH)4]-
B.若Y是盐酸,则溶液中可能含有的阳离子是Al3+
C.若Y是NaOH溶液,则bc段反应的离子方程式为Al(OH)3+OH-=[Al(OH)4]-
D.若Y是NaOH溶液,则X溶液中只存在四种离子,是Al3+、Fe3+、NH4+、Cl-