题目内容
【题目】氧硫化碳(COS,结构类似于CO2)广泛存在于以煤为原料的各种化工原料气中,能引起催化剂中毒、化学产品质量下降和大气污染。有多种方法可以脱氧硫化碳中的硫,其中氢解和水解反应是两种常用的脱硫方法,其反应式分别为:
①氢解反应:COS(g) + H2(g)H2S(g) + CO(g) ΔH1= + 7kJ/mol
②水解反应:COS(g) + H2O(g)H2S(g) + CO2(g) ΔH2= -35 kJ/mol
请回答下列问题:
(1)氧硫化碳的电子式为____________。
(2)CO2和H2能反应生成CO和H2O(g),写出该反应的热化学方程式______________。
(3)在密闭恒温(高于100℃)恒容装置中进行水解反应,下列能说明达到平衡状态的是___________________。
A.混合气体密度不再改变 B.混合气体压强不再改变
C.混合气体平均摩尔质量不再改变 D. COS(g) 的浓度不变
(4)①上述氢解反应的平衡常数K随温度降低而________(填“增大”或“减小”)。
②某温度下,体积为2L的恒容体系中,物质的量分别为m mol、n mol的COS蒸气和H2气发生氢解,已知COS的转化率为α,则该温度下的平衡常数K=___________(用m、n、α等符号表示)。
(5)某科研小组研究改进催化剂TiO2/Al2O3和温度对COS水解的影响,得到如图图像:
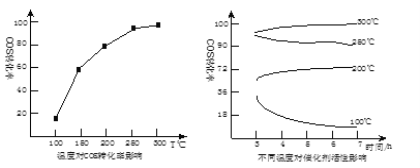
COS水解的最佳温度是 __________ ;理由是 ________ 。
【答案】![]() CO2(g)+H2(g)CO(g)+H2O(g) △H=+42kJ/mol D 减小 mα2 /(1-α)(n-mα) 300℃ 催化剂活性高,转化率很大
CO2(g)+H2(g)CO(g)+H2O(g) △H=+42kJ/mol D 减小 mα2 /(1-α)(n-mα) 300℃ 催化剂活性高,转化率很大
【解析】
(1)氧硫化碳是共价化合物,碳原子分别与氧原子、硫原子之间形成2个共用电子对;
(2)已知①COS(g) + H2(g)H2S(g) + CO(g) ΔH1 = + 7kJ/mol
②COS(g) + H2O(g)H2S(g) + CO2(g) ΔH2= -35 kJ/mol
根据盖斯定律,①-②得: CO2(g)+H2(g)CO(g)+H2O(g),据此计算△H3并写出热化学方程式;
(3)可逆反应的正逆反应速率相等,某一成分的百分含量保持不变的状态,可逆反应处于平衡状态;
(4)①氢解反应的正向是吸热反应,降低温度平衡逆向进行;
②假设反应容器体积为V L,COS起始物质的量为m,转化率为a,则变化量为m a,列出三段式:

将数据代入平衡常数表达式即可;
(5)由图中信息分析300℃时COS的转化率最高,催化剂的活性最强。
(1)氧硫化碳是共价化合物,碳原子分别与氧原子、硫原子之间形成2个共用电子对,其电子式为![]() ,
,
故答案为:![]() ;
;
(2)已知①COS(g) + H2(g)H2S(g) + CO(g) ΔH1 = + 7kJ/mol
②COS(g) + H2O(g)H2S(g) + CO2(g) ΔH2= -35 kJ/mol
根据盖斯定律,①②得: CO2(g)+H2(g)CO(g)+H2O(g) △H3= ΔH1 ΔH2= + 7kJ/mol(-35 kJ/mol)=+42kJ/mol,反应的热化学方程式为CO2(g)+H2(g)CO(g)+H2O(g) △H=+42kJ/mol ,
故答案为:CO2(g)+H2(g)CO(g)+H2O(g) △H=+42kJ/mol ;
水解反应:COS(g) + H2O(g)H2S(g) + CO2(g) 反应的特点是生成物和反应物都是气体并且是等物质的量的反应,
混合气体密度不再改变 ,因为反应物和生成物都是气体,反应前后气体的总质量不变,容器又是恒容的,所以密度不变不能作为平衡的依据,故A错误;
该水解反应是等物质的量的反应,反应前后气体的总物质的量不变,容器的体积不变,所以任意时刻压强不变,故B错误;
该水解反应是等物质的量的反应,反应前后气体的总物质的量不变,反应物和生成物都是气体,反应前后气体的总质量不变,得出平均摩尔质量不变,故C错误;
COS(g) 的浓度不变,说明正逆反应速率相等,处于平衡状态,故D正确;
故选:D。
(4)假设反应容器体积为VL,COS起始物质的量为m,转化率为a,则变化量为ma,则
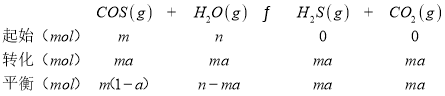 则平衡常数K=
则平衡常数K=![]() = mα2 /(1-α)(n-mα) ,
= mα2 /(1-α)(n-mα) ,
故答案为:mα2 /(1-α)(n-mα) ;
(5)由图中信息分析300℃时COS的转化率最高,催化剂的活性最强,则COS水解的最佳温度是300℃,此时催化剂活性高,转化率很大,
故答案为:300℃;催化剂活性高,转化率很大。