题目内容
【题目】用生产钛白的副产品FeSO4与软锰矿(主要成分是MnO2)可制备高纯MnO2
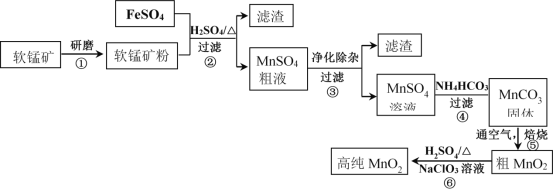
(1)步骤①中研磨的目的是______________________。
(2)步骤②中主要发生的反应是FeSO4与MnO2转化为MnSO4与__________。
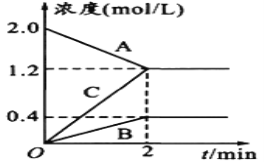
(3)步骤②中Mn2+浸出率受初始H2SO4浓度与温度的影响如下图所示。
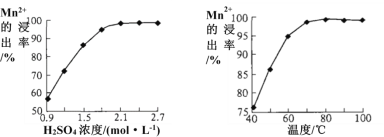
软锰矿粉酸浸的适宜条件是________________。
(4)步骤②中,若硫酸初始浓度小于1.8mol/L,反应进行一段时间后,有红褐色固体析出,其原因是____________。
(5)已知MnSO4粗液中还含有Al3+、Fe3+和Ni2+离子,溶液中离子生成氢氧化物的pH如下表:
Al(OH)3 | Fe(OH)3 | Ni(OH)2 | Mn(OH)2 | |
开始沉淀时pH | 3.4 | 1.5 | 6.9 | 8.2 |
完全沉淀时pH | 4.7 | 2.8 | 8.9 | 10.2 |
注:金属离子的起始浓度为0.1mol·L-1
步骤③进行的操作是:调节pH=5.4,过滤,滤渣中含_____________________。
(6)已知:几种难溶物的溶解平衡常数K
化学式 | MnCO3 | NiCO3 | MnS | NiS |
K | 2.24×10-11 | 1.42×10-7 | 4.65×10-14 | 1.07×10-21 |
步骤③还需加入的除杂试剂是_______固体(填序号)。
A.Na2CO3 B.MnCO3 C.Na2S D.MnS
(7)步骤⑤中焙烧MnCO3制MnO2,发生反应的化学方程式是_____________。
【答案】增大反应面积,加快化学反应速率 Fe2(SO4)3 硫酸浓度2.1mol/L,T=70℃ 随着反应进行,pH变大,Fe3+水解生成Fe(OH)3 Al(OH)3、Fe(OH)3 D 2MnCO3+O2![]() 2MnO2+2CO2
2MnO2+2CO2
【解析】
软锰矿粉碎后,能增大与硫酸亚铁、硫酸的接触面积,提高反应速率;软锰矿与硫酸亚铁反应生成硫酸锰和硫酸铁;通过调节pH,除去溶液中的铁离子,得到硫酸锰,在经过提纯得到高纯二氧化锰。
(1)步骤①中研磨使软锰矿变为细小颗粒,可增大反应面积,提高反应速率;
(2)步骤②中Mn的化合价降低,则Fe的化合价升高,则生成硫酸铁;
(3)根据图像信息,Mn2+浸出率高时,硫酸的浓度为2.1mol/L,温度为70℃;
(4)随反应的进行,硫酸越来越少,溶液的pH逐渐增大,铁离子水解程度增大,生成氢氧化铁的量增大;
(5)根据表中数据,调节pH=5.4,溶液中的Al3+、Fe3+完全变为沉淀,则滤渣的成分为Al(OH)3、Fe(OH)3;
(6)根据表中给定的Ksp,Ksp(MnS)>Ksp(NiS),加入MnS即可除去溶液中的Ni2+,答案为D;
(7)步骤⑤中通入空气焙烧MnCO3制MnO2,Mn的化合价升高,则空气中的氧气参与反应,化合价降低,反应的方程式为2MnCO3+O2![]() 2MnO2+2CO2。
2MnO2+2CO2。

【题目】室温下进行下列实验,根据实验操作和现象所得到的结论正确的是( )
选项 | 实验操作和现象 | 结论 |
A | 向苯酚钠溶液中滴加NaHSO3溶液,溶液变浑浊 | 苯酚酸性弱于H2SO3酸性 |
B | 向AgNO3溶液中逐滴加入浓度均为0.05 mol·L-1的NaI、NaCl混合溶液,有黄色沉淀生成 | Ksp(AgCl)>Ksp(AgI) |
C | 向FeCl3溶液中加入Cu粉,Cu粉溶解 | Cu的还原性大于Fe |
D | 向盛有H2O2溶液的试管中滴几滴酸化的FeCl2溶液,溶液变成棕黄色,一段时间后,溶液中有气泡出现 | 铁离子催化H2O2的分解 |
A.AB.BC.CD.D