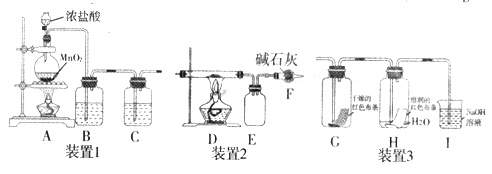
��Ŀ����
����Ŀ������A��B��C��D��E��F��G��H��I��J��K����ͼת����ϵ��D��EΪ���嵥�ʣ�����DΪ��������塣�Իش�
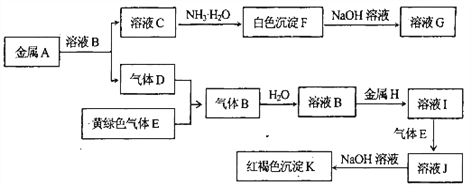
��1��д������K�Ļ�ѧʽ _______________��
��2��д��A��NaOH��Һ��Ӧ�Ļ�ѧ����ʽ��______________________________________��
��3��д����Ӧ��I��J�������ӷ���ʽ��____________________________________________��
��4������ҺI�е���NaOH��Һ���ɹ۲쵽�������ǣ�_______________________________��
��5����1 L 0.2mol/L��C��Һ�м���a ml 5mol/L��NaOH��Һ�õ���7.8g��������a=____mL��
���𰸡� Fe(OH)3 2Al+2NaOH+2H2O=2NaAlO2+3H2�� 2Fe2+��Cl2=2Fe3+ +2Cl- �ȳ��ְ�ɫ�������漴��ɻ���ɫ������ɺ��ɫ 60����140
��������D��EΪ���嵥�ʣ�����DΪ��������壬D��������E�ǻ���ɫ���壬E����������������������B���Ȼ��⣬����ˮ�õ����ᡣ���ɫ����K�����������������H������I���Ȼ���������������Ӧ����J���Ȼ�����C��Һ�백ˮ��Ӧ���ɰ�ɫ����F��F����������������Һ�У���F������������G��ƫ�����ƣ�����A��Al��C���Ȼ�������
��1������K�Ļ�ѧʽΪFe(OH)3����2������NaOH��Һ��Ӧ�Ļ�ѧ����ʽΪ2Al+2NaOH+2H2O=2NaAlO2+3H2������3����Ӧ��I��J�������ӷ���ʽΪ2Fe2+��Cl2=2Fe3++2Cl-����4�����Ȼ�������Һ�е���NaOH��Һ���ɹ۲쵽���������ȳ��ְ�ɫ�������漴��ɻ���ɫ������ɺ��ɫ����5��1 L 0.2mol/L��AlCl3��Һ���Ȼ��������ʵ�����0.2mol����AlԪ�ض�ת��Ϊ����������������������������������=0.2mol��78g/mol=15.6g��7.8g��˵�������������һΪ��������ȫ��ֻ��������������������һ�����Ϊ���������ܽ⣬��������������������������NaAlO2���������������ʵ�����7.8g��78g/mol=0.1mol��������㣬��Al3����3OH��===Al(OH)3����֪NaOH�����ʵ���Ϊ0.1mol��3=0.3mol������NaOH��Һ�����Ϊ0.3mol��5mol/L=0.06L=60mL���ڳ��������ܽ⣬��
Al3����3OH��===Al(OH)3��
0.2mol 0.6mol 0.6mol
�ܽ����������Ϊ0.2mol-0.1mol=0.1mol
Al(OH)3��OH��===AlO2����2H2O
0.1mol 0.1mol
�����ĵļ�����ʵ���Ϊ0.6mol+0.1mol=0.7mol������NaOH��Һ�����Ϊ0.7mol��5mol/L=0.14L=140mL��

 ����ѧ����ϵ�д�
����ѧ����ϵ�д�