题目内容
【题目】研究 CO2在海洋中的转移和归宿,是当今海洋科学研究的前沿领域。
(1)溶于海水的 CO2 主要以 4 种无机碳形式存在,其中 HCO3-占 95%,写出 CO2溶于水产生 HCO3-的方程式: ___________、___________。
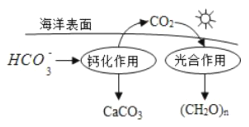
(2)在海洋循环中,通过如图所示的途径固碳, 写出钙化作用的离子方程式__________。
(3)海水中溶解无机碳占海水总碳的 95%以上,其准确测量是研究海洋碳循环的基础,测量溶解无机碳,可采用如下方法:①气提、吸收 CO2 。用 N2 从 H2SO4溶液酸化后的 Z mL海水中吹出 CO2 并用碱液吸收(装置如图)
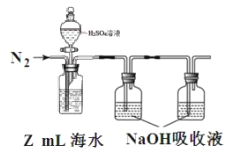
②滴定。将吸收液吸收的无机碳转化为 NaHCO3,再用x mol/L盐酸滴定,消耗y mL盐酸,则海水中溶解无机碳的浓度=________mol/L。
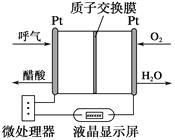
(4)利用下图所示装置从海水中提取 CO2,有利于减少环境温室气体含量。
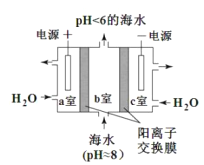
①提取CO2 的原理:_____(填 a 或 b)室产生的 H+ 通过阳离子膜进入b 室,发生反应:。 ________。
②用该装置产生的物质处理 b 室排出的海水,合格后排回大海。处理至合格的具体方法是__________。
【答案】 CO2+H2O![]() H2CO3 H2CO3
H2CO3 H2CO3![]() HCO3-+H+ Ca2++2HCO3-= CaCO3↓+CO2↑+H2O xy/z a HCO3-+H+=CO2↑+H2O 用c 室排除的碱液将从b 室排出的酸性海水调节至接近装置入口海水的pH
HCO3-+H+ Ca2++2HCO3-= CaCO3↓+CO2↑+H2O xy/z a HCO3-+H+=CO2↑+H2O 用c 室排除的碱液将从b 室排出的酸性海水调节至接近装置入口海水的pH
【解析】(1)二氧化碳溶于水生成的碳酸为弱酸,部分电离生成碳酸氢根,有关方程式为:CO2+H2O![]() H2CO3、H2CO3
H2CO3、H2CO3![]() HCO3-+H+;(2)反应物中含有碳酸氢根,生成物为碳酸钙,依据元素守恒以及电荷守恒得出方程式为:Ca2++2HCO3-= CaCO3↓+CO2↑+H2O;(3)此反应原理为:NaHCO3+HCl=NaCl+CO2↑+H2O,即碳酸氢钠与盐酸的物质的量之比为1:1,那么海水中碳酸氢钠的浓度为c,体积均为mL,依据题意有c×z=xy,解c=
HCO3-+H+;(2)反应物中含有碳酸氢根,生成物为碳酸钙,依据元素守恒以及电荷守恒得出方程式为:Ca2++2HCO3-= CaCO3↓+CO2↑+H2O;(3)此反应原理为:NaHCO3+HCl=NaCl+CO2↑+H2O,即碳酸氢钠与盐酸的物质的量之比为1:1,那么海水中碳酸氢钠的浓度为c,体积均为mL,依据题意有c×z=xy,解c=![]() ;(4)a室:2H2O-4e-=4H++O2↑,氢离子通过阳离子交换膜进入b室,发生反应:H++HCO3-=CO2↑+H2O;②c室:2H2O+2e-=2OH-+H2↑,用c室排出的碱液将从b室排出的酸性海水调节至装置入口海水的pH。
;(4)a室:2H2O-4e-=4H++O2↑,氢离子通过阳离子交换膜进入b室,发生反应:H++HCO3-=CO2↑+H2O;②c室:2H2O+2e-=2OH-+H2↑,用c室排出的碱液将从b室排出的酸性海水调节至装置入口海水的pH。

 通城学典默写能手系列答案
通城学典默写能手系列答案