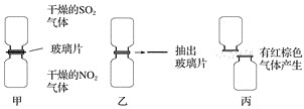
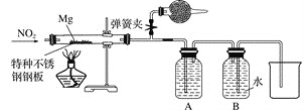
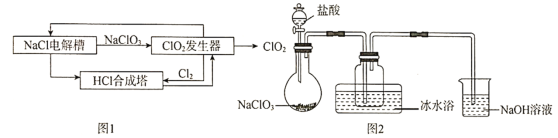
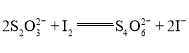题目内容
【题目】标况下,一容积不变的密闭容器里充满硫化氢和氧气的混合气体,点燃恰好完全反应后,恢复至原状态,压强变为原来的![]() ,计算原混合气体的硫化氢和氧气的体积比________。
,计算原混合气体的硫化氢和氧气的体积比________。
【答案】4∶5
【解析】
硫化氢燃烧可以发生反应:①2H2S+O2![]() 2S+2H2O,②2H2S+3O2
2S+2H2O,②2H2S+3O2![]() 2SO2+2H2O,反应前后都在标况下,恢复至原状态,若只发生①,反应后压强为0;若只发生反应②,反应后压强变为原来的
2SO2+2H2O,反应前后都在标况下,恢复至原状态,若只发生①,反应后压强为0;若只发生反应②,反应后压强变为原来的![]() ,根据方程式对应关系可以求得答案。
,根据方程式对应关系可以求得答案。
硫化氢燃烧可以发生反应:①2H2S+O2![]() 2S+2H2O,②2H2S+3O2
2S+2H2O,②2H2S+3O2![]() 2SO2+2H2O,反应前后都在标况下,恢复至原状态,若只发生①,反应后压强为0;若只发生反应②,反应后压强变为原来的
2SO2+2H2O,反应前后都在标况下,恢复至原状态,若只发生①,反应后压强为0;若只发生反应②,反应后压强变为原来的![]() 。由题目信息得压强变为原来的
。由题目信息得压强变为原来的![]() ,则反应①、②都发生。又根据相同条件下压强之比等于气体物质的量之比,假设反应后气体物质的量为1mol,即反应后二氧化硫的物质的量为1mol,则反应前混合气体总物质的量为3 mol,则根据反应:
,则反应①、②都发生。又根据相同条件下压强之比等于气体物质的量之比,假设反应后气体物质的量为1mol,即反应后二氧化硫的物质的量为1mol,则反应前混合气体总物质的量为3 mol,则根据反应:

n(H2S)=1mol,n(O2)=1.5mol,消耗的H2S和O2分别为1mol和1.5mol,故硫化氢燃烧生成硫与水的反应中,n(H2S)+n(O2)=3mol-1mol-1.5mol=0.5 mol。由反应:2H2S+O2![]() 2S↓+2H2O,可知n(H2S)=0.5 mol×
2S↓+2H2O,可知n(H2S)=0.5 mol×![]() =
=![]() mol,n(O2)=0.5 mol×
mol,n(O2)=0.5 mol×![]() =
=![]() mol。原混合气体的硫化氢和氧气的体积比等于其物质的量之比,为(1 mol+
mol。原混合气体的硫化氢和氧气的体积比等于其物质的量之比,为(1 mol+![]() mol)∶(1.5 mol+
mol)∶(1.5 mol+![]() mol)=4∶5。
mol)=4∶5。

 口算小状元口算速算天天练系列答案
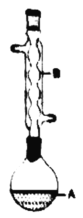
口算小状元口算速算天天练系列答案【题目】乙酸异戊酯是组成蜜蜂信息素的成分之一,具有香蕉的香味。实验室制备乙酸异戊酯的反应、装置示意图和有关数据如下:

![]()
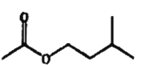 +H2O
+H2O
物质 | 相对分子质量 | 密度 | 沸点/℃ | 水中溶解性 |
异戊醇 | 88 | 0.8123 | 131 | 微溶 |
乙酸 | 60 | 1.0492 | 118 | 溶 |
乙酸异戊酯 | 130 | 0.8670 | 142 | 难溶 |
实验步骤:
在A中加入4.4g的异戊醇,6.0g的乙酸、数滴浓硫酸和2~3片碎瓷片,开始缓慢加热A,回流50min,反应液冷至室温后倒入分液漏斗中,分别用少量水,饱和碳酸氢钠溶液和水洗涤,分出的产物加入少量无水![]() 固体,静置片刻,过滤除去
固体,静置片刻,过滤除去![]() 固体,进行蒸馏纯化,收集140~143℃馏分,得乙酸异戊酯3.9g。回答下列问题:
固体,进行蒸馏纯化,收集140~143℃馏分,得乙酸异戊酯3.9g。回答下列问题:
(1)仪器A的名称是:________
(2)在洗涤操作中,第一次水洗的主要目的是:________;第二次水洗的主要目的是:________。
(3)在洗涤、分液操作中,应充分振荡,然后静置,待分层后________(填标号)。
a.直接将乙酸异戊酯从分液漏斗上口倒出
b.直接将乙酸异戊酯从分液漏斗下口放出
c..先将水层从分液漏斗的下口放出,再将乙酸异戊酯从下口放出
d.先将水层从分液漏斗的下口放出,再将乙酸异戊酯从上口放出
(4)本实验中加入过量乙酸的目的是:________________。
(5)实验中加入少量浓硫酸的目的是:________________。
(6)在蒸馏操作中加热一段时间发现忘加碎瓷片,应采取的正确操作是:________。(请用文字描述)
(7)本实验的产率是:________(
a.30% b.40% c.50% d.60%
(8)在进行蒸馏操作时,若从110℃便开始收集馏分,会使实验的产率偏________(填“高”或“低”),其原因是_______________________________________________。
【题目】硫酸镍广泛应用于电镀、催化、医药等行业中,具有很高的经济价值。一种用含镍废催化剂(主要含![]() 、C,还含有铝、铁的单质及氧化物,和少量有机物)为原料制备
、C,还含有铝、铁的单质及氧化物,和少量有机物)为原料制备![]() 的工艺流程如下:
的工艺流程如下:

部分阳离子以氢氧化物形式沉淀时的![]() 如下:
如下:
沉淀物 | 开始沉淀时的 | 完全沉淀时的 |
| 2.7 | 3.2 |
| 7.6 | 9.7 |
| 7.1 | 9.2 |
回答下列问题:
(1)滤液a中溶质的主要成分除![]() 外,还含有_________________(填化学式)。
外,还含有_________________(填化学式)。
(2)酸溶前需进行“热处理”的主要目的是____________;滤渣b主要成分是________(填化学式)。
(3)加入![]() 溶液时发生反应的离子方程式为_______;简述加入
溶液时发生反应的离子方程式为_______;简述加入![]() 除杂的原理_______。
除杂的原理_______。
(4)操作d为________、过滤、洗涤、干燥;产品晶体中有时会混有少量![]() ,其原因可能是__________。(写出一点即可)
,其原因可能是__________。(写出一点即可)
(5)取ag上述流程制得的硫酸镍晶体样品溶于蒸馏水中,在不断搅拌下缓慢加入足量丁二酮肟溶液![]() ,再加入
,再加入![]() 溶液调节溶液的
溶液调节溶液的![]() 在8~9,充分反应后,过滤、洗涤、烘干、称量得到红色固体质量为bg。发生反应的方程式为
在8~9,充分反应后,过滤、洗涤、烘干、称量得到红色固体质量为bg。发生反应的方程式为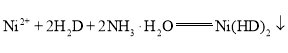 (红色)
(红色)![]() ,已知
,已知![]() 相对分子质量为M,列式计算样品纯度为_________。
相对分子质量为M,列式计算样品纯度为_________。