题目内容
2.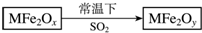 新型纳米材料MFe2Ox(3<x<4)中M表示+2价的金属元素,在反应中化合价不发生变化.常温下,MFe2Ox能使工业废气中的SO2转化为S,流程如图,则下列判断正确的是( )
新型纳米材料MFe2Ox(3<x<4)中M表示+2价的金属元素,在反应中化合价不发生变化.常温下,MFe2Ox能使工业废气中的SO2转化为S,流程如图,则下列判断正确的是( )| A. | MFe2Ox是氧化剂 | B. | SO2是该反应的催化剂 | ||
| C. | x<y | D. | MFe2Oy是还原产物 |
分析 在反应中,SO2转化为S,S元素化合价降低,说明SO2在反应中为氧化剂,则MFe2Ox为还原剂,反应后Fe元素的化合价升高,根据Fe元素常见化合价为+2、+3价判断x、y大小关系.
解答 解:A.SO2转化为S,S元素化合价降低,说明SO2在反应中为氧化剂,则MFe2Ox为还原剂,故A错误;
B.SO2在反应中转化为S为氧化剂,不是催化剂,故B错误;
C.MFe2Ox为还原剂生成MFe2Oy,反应后Fe元素的化合价升高,根据化合价代数和,则有(2y-2)>(2x-2),即x<y,故C正确;
D.SO2转化为S,S元素化合价降低,说明SO2在反应中为氧化剂,则MFe2Ox为还原剂,所以MFe2Oy是氧化产物,故D错误.
故选C.
点评 本题主要考查学生根据题目所给的信息和所学的化学知识进行解题的能力,解答时注意根据化合价的变化和化合物化合价代数和为0分析解答问题,要细心分析,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
12.小苏打作为食品制作过程中的膨松剂在食品加工产业上有广泛的用途.

(1)某小组拟研究放置己久的小苏打样品中纯碱的质量分数.限选试剂和仪器:NaHCO3样品、碱石灰、0.1mol/LHCl、0.1mol/LH2SO4、浓H2SO4、烧瓶、双孔塞、玻璃导管、胶管、广口瓶、干燥管.
①写出本实验小苏打样品与酸反应的全部化学方程式(两条)2NaHCO3+H2SO4=Na2SO4+2CO2↑+2H2O,Na2CO3+H2SO4=Na2SO4+CO2↑+H2O.
②设计实验方案:实验中除称量样品质量外,还需测定生成CO2的质量.
③设计实验装置,完成下图装置示意图及标注.
④参照下表格式,拟定实验表格,完整体现实验方案(列出所选试剂质量,需记录的待测物理量和所拟定的数据;数据用字母表示).
(2)根据此实验得到的数据,测定结果有误差.因为实验装置还存在一个明显缺陷,该缺陷是需设计一个将A、B中的CO2全部吹入C中的装置.

(1)某小组拟研究放置己久的小苏打样品中纯碱的质量分数.限选试剂和仪器:NaHCO3样品、碱石灰、0.1mol/LHCl、0.1mol/LH2SO4、浓H2SO4、烧瓶、双孔塞、玻璃导管、胶管、广口瓶、干燥管.
①写出本实验小苏打样品与酸反应的全部化学方程式(两条)2NaHCO3+H2SO4=Na2SO4+2CO2↑+2H2O,Na2CO3+H2SO4=Na2SO4+CO2↑+H2O.
②设计实验方案:实验中除称量样品质量外,还需测定生成CO2的质量.
③设计实验装置,完成下图装置示意图及标注.
④参照下表格式,拟定实验表格,完整体现实验方案(列出所选试剂质量,需记录的待测物理量和所拟定的数据;数据用字母表示).
| 物理量 | 样品质量/g | … | ||
| 实 验 | a | … |
17.下列离子方程式正确的是( )
| A. | 向AlCl3溶液中逐渐滴入NaOH溶液至过量:Al3++3OH-═Al(OH)3↓ | |
| B. | 向NaOH溶液中逐渐滴入AlCl3溶液至过量:Al3++4OH-═AlO2-+2H2O | |
| C. | 在氨水中加入几滴硝酸铁溶液:Fe3++3OH-═Fe(OH)3↓ | |
| D. | 向Na2CO3溶液中滴加几滴稀盐酸:CO32-+H+═HCO3- |
11.下列有机物的名称肯定错误的是( )
| A. | 1,1,2,2-四溴乙烷 | B. | 1,4-丁二醇 | ||
| C. | 2-氯丙酸 | D. | 2-甲基-3-丁烯 |
 A、B、X、Y均为中学阶段的常见物质,它们之间的转化关系如图所示:请回答下列问题:
A、B、X、Y均为中学阶段的常见物质,它们之间的转化关系如图所示:请回答下列问题: 某化学兴趣小组同学利用侯德榜制碱法的原理制得了一些纯碱,经检验,样品中含有少量NH4Cl.现欲用实验测定样品的纯度,设计了多种探究方案:
某化学兴趣小组同学利用侯德榜制碱法的原理制得了一些纯碱,经检验,样品中含有少量NH4Cl.现欲用实验测定样品的纯度,设计了多种探究方案: