题目内容
12.将足量的锌粒放入100mL 1.0mol/L的盐酸中,充分反应.计算:(1)参加反应的锌的质量;
(2)生成H2的体积(标准状况下)
分析 发生反应:Zn+2HCl=ZnCl2+H2 ↑,根据n=cV计算HCl的物质的量,再根据方程式计算.
解答 解:Zn足量,盐酸完全反应,HCl的物质的量为0.1L×1.0mol/L=0.1mol,
设参加反应Zn的质量为m,生成氢气的体积为V,则:
Zn+2 HCl=ZnCl2+H2 ↑
65g 2mol 22.4L
m 0.1mol V
所以m=$\frac{65g×0.1mol}{2mol}$=3.25g
V=$\frac{0.1mol×22.4L}{2mol}$=1.12L
答:(1)参加反应的锌的质量为3.25g;
(2)生成H2的体积(标准状况下)为1.12L.
点评 本题考查根据方程式进行的计算,难度不大,有利于对基础知识的巩固.

练习册系列答案
相关题目
2.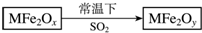 新型纳米材料MFe2Ox(3<x<4)中M表示+2价的金属元素,在反应中化合价不发生变化.常温下,MFe2Ox能使工业废气中的SO2转化为S,流程如图,则下列判断正确的是( )
新型纳米材料MFe2Ox(3<x<4)中M表示+2价的金属元素,在反应中化合价不发生变化.常温下,MFe2Ox能使工业废气中的SO2转化为S,流程如图,则下列判断正确的是( )
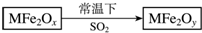 新型纳米材料MFe2Ox(3<x<4)中M表示+2价的金属元素,在反应中化合价不发生变化.常温下,MFe2Ox能使工业废气中的SO2转化为S,流程如图,则下列判断正确的是( )
新型纳米材料MFe2Ox(3<x<4)中M表示+2价的金属元素,在反应中化合价不发生变化.常温下,MFe2Ox能使工业废气中的SO2转化为S,流程如图,则下列判断正确的是( )| A. | MFe2Ox是氧化剂 | B. | SO2是该反应的催化剂 | ||
| C. | x<y | D. | MFe2Oy是还原产物 |
3.在化学学习与研究中类推的思维方法有时会产生错误的结论,因此类推的结论最终要经过实践的检验才能确定其正确与否.下列几种类推结论中,不正确的是( )
| A. | CO2不能与CaCl2溶液反应,则SO2也不能与CaCl2溶液反应 | |
| B. | 金属钠着火不能用CO2扑灭,则金属钾着火也不能用CO2扑灭 | |
| C. | Al2O3可溶于强酸和强碱,则BeO也可溶于强酸和强碱 | |
| D. | Mg (OH)2难溶于水,则Ca(OH)2也难溶于水 |
7.温度体积固定的容器中建立2NO2?N2O4平衡,平衡时NO2与N2O4物质的量浓度之比为σ,条件不变的情况下,分别再充入NO2和再充入N2O4平衡后会引起σ的变化正确的是( )
| A. | 都引起σ增大 | |
| B. | 都引起σ减小 | |
| C. | 充入NO2引起σ增大,充入N2O4引起σ减小 | |
| D. | 充入NO2引起σ减小,充入N2O4引起σ增大 |
17.烷烃发生光卤代反应时,各种产物的含量与所取代的氢原子的活性有关,例如:CH3CH2CH3+Cl2$\stackrel{hy}{→}$CH3CH2CH2Cl(45%)+CH3CHClCH3(55%),据此,丙烷分子中的两种氢原子反应活性(发生反应的难易程度)之比为( )
| A. | 9:11 | B. | 11:9 | C. | 3:11 | D. | 27:11 |
15.下列判断中一定正确的是( )
| A. | 若R2+和M+的电子层结构相同,则碱性:ROH>MOH | |
| B. | 若X2、Y2都是气态单质,且酸性HX>HY,则非金属性X>Y | |
| C. | 若A2+2D-=2A-+D2,则还原性:D->A- | |
| D. | 若M、N是同主族元素,且原子序数:M>N,则非金属性:M>N |
16.下列有机物的命名正确的是( )
| A. | 1,2─二甲基戊烷 | B. | 3─乙基戊烷 | C. | 3,4─二甲基戊烷 | D. | 2─甲基己烷 |
 ;
;