题目内容
【题目】完成下列化学方程式,并标明反应类型.
(1)CH4+Cl2![]() _____,_____;(只写产物均为气体的一个)
_____,_____;(只写产物均为气体的一个)
(2)CH2=CH2+Br2→__________,____________;
(3)![]() +Br2
+Br2![]() _________,_____。
_________,_____。
(4)与乙烯和氢气的加成产物互为同系物的是_____(填写编号)。
a C2H2 b C6H6 c C5H12 d C2H6O
(5)请写出乙烯加聚反应方程式_________
【答案】CH3Cl、HCl 取代反应 CH2Br-CH2Br 加成反应 :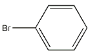 、HBr 取代反应 c
、HBr 取代反应 c 
【解析】
(1)甲烷在光照条件下与氯气发生取代反应,生成CH3Cl、CH2Cl2、CHCl3、CCl4和HCl,其中CH3Cl和HCl为气体,CH2Cl2、CHCl3、CCl4为油状液体,所以产物均为气体的反应方程式为:CH4+Cl2![]() CH3Cl+HCl,故答案为:CH3Cl、HCl;取代反应。
CH3Cl+HCl,故答案为:CH3Cl、HCl;取代反应。
(2)乙烯与溴单质发生加成反应生成1,2-二溴乙烷,其反应方程式为:CH2=CH2+Br2→CH2Br-CH2Br,故答案为:CH2Br-CH2Br;加成反应。
(3)苯与液溴在溴化铁作催化剂条件下发生取代反应生成溴苯和溴化氢,其反应方程式为: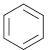 +Br2
+Br2![]()
 +HBr,故答案为:
+HBr,故答案为: 、HBr;取代反应。
、HBr;取代反应。
(4)乙烯与氢气发生加成反应生成乙烷,同系物是指结构相似,分子式之间相差若干个CH2的有机物,与乙烷互为同系物的是C5H12,故答案为:c。
(5)乙烯中含有碳碳双键,发生加聚反应生成聚乙烯,其反应方程式为: ,故答案为:
,故答案为: 。
。

【题目】在一定温度下,将气体0.22 mol X和气体0.16 mol Y充入5 L恒容密闭容器中,发生反应2X(g) + Y(g) ![]() 2Z(g) △H<0,一段时间后达到平衡,反应过程中测定的数据如下表:
2Z(g) △H<0,一段时间后达到平衡,反应过程中测定的数据如下表:
t/min | 2 | 4 | 7 | 9 |
n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
下列说法正确的是( )
A. 该温度下此反应的平衡常数K = 72.0 L/mol
B. 反应前2 min的平均速率υ(Z) = 4.0×10-3 mol/(L·min)
C. 其他条件不变,降低温度,反应达到新平衡前υ(逆) > υ(正)
D. 其他条件不变,再充入0.1 mo1 X,新平衡时X的转化率将增大
【题目】以下实验方案合理的是( )
实验目的 | 实验设计 | |
A | 鉴别乙醇和二甲醚 | 分别取少量样品用元素分析仪进行测定 |
B | 用高锰酸钾溶液滴定未知浓度的乙二酸溶液 | 用待装液体分别润洗酸式和碱式滴定管再进行操作 |
C | 确定某无色溶液中含有 | 取少量待测液加 |
D | 鉴别 | 分别滴加氨水至过量,观察现象 |
A. AB. BC. CD. D
【题目】元素周期表中的四种元素![]() 的有关信息如下,请用合理的化学用语填写空白。
的有关信息如下,请用合理的化学用语填写空白。
在周期表中的区域 | 元素代号 | 有关信息 |
短周期元素 |
|
|
|
| |
长周期元素 |
|
|
|
|
(1)![]() 元素周期表中的位置为___________,
元素周期表中的位置为___________,![]() 、
、![]() 、
、![]() 三种元素的简单离子半径从大到小的顺序为__________。
三种元素的简单离子半径从大到小的顺序为__________。
(2)足量![]() 的最高价氧化物的水化物的稀溶液与
的最高价氧化物的水化物的稀溶液与![]() 甲完全反应,放出热量
甲完全反应,放出热量![]() ,请写出表示该过程中和热的热化学方程式____________。
,请写出表示该过程中和热的热化学方程式____________。
(3)下列有关![]() 的气态氢化物丁的说法正确的有_____________(选填字母)
的气态氢化物丁的说法正确的有_____________(选填字母)
a、丁比氯化氢沸点高 b、丁比氯化氢稳定性好
c、丁比氟化氢还原性强 d、丁比氟化氢酸性弱
(4)请写出丙溶于丁的水溶液的离子方程式____________;乙的水溶液呈酸性,请写出离子方程式解释原因_____________。
(5)![]() 是一种弱酸,请写出它的电离方程式__________________;
是一种弱酸,请写出它的电离方程式__________________;![]() 溶液有剧毒,可以用
溶液有剧毒,可以用![]() 溶液进行无毒化处理,请写出二者反应的化学方程式__________________;室温下,
溶液进行无毒化处理,请写出二者反应的化学方程式__________________;室温下,![]() 的电离常数
的电离常数![]() ,在
,在![]() 的
的![]() 溶液中滴加同浓度盐酸至溶液呈中性,此时溶液中的
溶液中滴加同浓度盐酸至溶液呈中性,此时溶液中的 _____________。
_____________。