��Ŀ����
����Ŀ��[��ѧ��ѡ��2����ѧ�뼼��]
��ˮռ�����ܴ�ˮ����97.2�������Ѻ�ˮ�����ͻ�������������������ܽ����ˮ��Դȱ�������⣬���ܳ�����ú�����Դ��
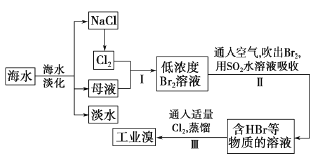
��ͼ�����ú�ˮ��Դ���л��������IJ��ֹ�������ʾ��ͼ��

��1���ù�������ʾ��ͼ�а����� �� ���ѧ��ҵ�����ƣ���
��2�������̢��У�����ȥ�����к��е�Ca2����Mg2����SO42�������ӣ��轫�����ܽ��˳�����ҩƷ���г��������˵ȡ�����ҩƷ�Ͳ�����˳������� ������ĸ����
A��Na2CO3��NaOH�� BaCl2�����ˡ�����
B��NaOH�� BaCl2�� Na2CO3�����ˡ�����
C��NaOH�� Na2CO3�� BaCl2�����ˡ�����
D��BaCl2��Na2CO3�� NaOH�� ���ˡ�����
��3�����̢��У�ͨ�翪ʼ�������������������� (�ѧʽ)������������ҺpH�� �����������С�����䡱����
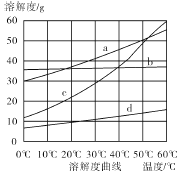
��4�����̢��У�ͨ����Ӧ��ѧ��Ӧ���Եõ�NaHCO3���塣��ͼΪNaCl��NH4Cl��NaHCO3��NH4HCO3���ܽ�����ߣ������ܱ�ʾNaHCO3�ܽ�����ߵ��� ������NaHCO3����Ļ�ѧ��Ӧ����ʽ�� ��
��5�����̢��У����ô�������������������ʣ����õ��ᴿ������ �������ƣ���ͨ���÷��ᴿ��õ�������Na2CO3��10H2O��Na2CO3��10H2O��ˮ�õ���ˮ̼���ơ�
��֪��Na2CO3��H2O(s)=Na2CO3(s)+H2O(g) ��H1=+58.73kJ��mol-1
Na2CO3��10H2O(s)=Na2CO3��H2O(s)+9H2O(g) ��H2=+473.63 kJ��mol-1
����ˮ���̲�������̬ˮ��ȫҺ���ͷŵ�����ȫ����������Na2CO3������ܺģ�������������ʧ����������1molNa2CO3��Ҫ����92.36kJ���ɴ˵ó���H2O(g��= H2O(l) ��H= ��
���𰸡���1���ȼҵ�������Ƽ�
��2��bd
��3��Cl2������
��4��d NaCl + CO2 + NH3 + H2O = NaHCO3��+ NH4Cl��
��5���ؽᾧ(2��) - 44.00 kJ/mol��
��������
�����������1������ʾ��ͼ��֪�ù�������ʾ��ͼ�а������ȼҵ�������Ƽ
��2��Ca2����̼���Ƴ�ȥ��Mg2�����������Ƴ�ȥ��SO42�����Ȼ�����ȥ�������������ữ�������ڹ������Ȼ���Ҫ��̼��������������̼���Ʊ�������Ȼ����ĺ��棬���������ƿ��������������ѡbd��
��3�����̢��У�ͨ�翪ʼ�������������ӷŵ磬������������Cl2�������������ӷŵ磬ͬʱ�ƻ�ˮ�еĵ���ƽ�⣬��Һ��������Ũ�ȴ���������Ũ�ȣ�������������ҺpH������
��4�����̢�������̼�����ƾ��壬˵���ܽ����С���������ܱ�ʾNaHCO3�ܽ�����ߵ���d������NaHCO3����Ļ�ѧ��Ӧ����ʽ��NaCl+CO2+NH3+H2O��NaHCO3��+NH4Cl��
��5�����̢��У����ô�������������������ʣ����õ��ᴿ�������ؽᾧ����֪��
��Na2CO3��H2O(s)=Na2CO3(s)+H2O(g) ��H1=+58.73kJ��mol-1
��Na2CO3��10H2O(s)=Na2CO3��H2O(s)+9H2O(g) ��H2=+473.63 kJ��mol-1
����ݸ�˹���ɿ�֪��+�����õ���Ӧ��Na2CO3��10H2O(s)= Na2CO3(s)+10H2O(g)�ķ�Ӧ����H��+532.36 kJ/mol��������1molNa2CO3��Ҫ����92.36kJ����õ���Ӧ��Na2CO3��10H2O(s)��Na2CO3(s)+10H2O(l)�ķ�Ӧ����H��+92.36 kJ/mol����ˣ���������/10�ɵõ�H2O(g��= H2O(l)����H=��44kJ/mol��

����Ŀ����ͼ����Zn��CuΪ�缫��ϡH2SO4Ϊ�������Һ�γɵ�ԭ��أ�ijʵ����ȤС������ʵ����ڶ��鿨Ƭ�ϼ�¼���£�
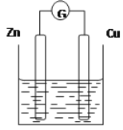
Date��2016.03.06 ʵ���ļ�¼�� ��ZnΪ������CuΪ���� ��H+���ƶ� �۵�����������Zn��Cu ��Cu����H2���� ������1mol�����������ߣ�������H2Ϊ0.5mol �������ĵ缫��Ӧʽ��Zn�D2e�D��Zn2�� |
��1���ڿ�Ƭ�ϣ������������� ������ţ���
��2����ʵ���У���ͬѧ���ֲ�����ͭƬ�������ݲ�����������пƬ��Ҳ���������壬����ԭ������� ��
��3�������пƬ����ʯī�����ֵ�����ָ�뼸������ƫת��ԭ���� ��
��4����������ỻ������ͭ��Һ���²� ������п��������ͭ��������֣�ԭ���� ���õ缫����ʽ��ʾ����