题目内容
【题目】下列表述不正确的是
A | B | C | D |
|
|
|
|
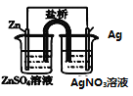
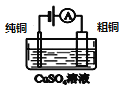
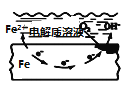
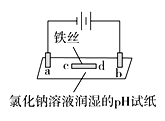
盐桥中的Cl-移向AgNO3溶液 | a极附近产生的气体能使湿润的淀粉碘化钾试纸变蓝 | 纯铜的电极反应式为:Cu2++2e-=Cu | 正极反应式为: O2+2H2O+4e-=4OH- |
A. AB. BC. CD. D
【答案】A
【解析】
A、该原电池锌、硫酸锌溶液为负极,原电池中阴离子移向负极,阳离子移向正极,则Cl-移向ZnSO4溶液,故A错误;
B、该电解池中,a与电源正极相连是阳极,溶液中氯离子失电子生成氯气,2Cl--2e-=Cl2↑,氯气和碘化钾反应生成碘单质,使湿润的淀粉碘化钾试纸变蓝,故B正确;
C、该电解池中,粗铜与电源正极相连是阳极,电极反应式为Cu-2e-=Cu2+、Fe-2e-=Fe2+等,纯铜作阴极,发生还原反应,电极反应式为:Cu2++2e-=Cu,故C正确;
D、根据图示,发生的腐蚀为吸氧腐蚀,正极反应为O2+4e-+2H2O=4OH-,故D正确;
故选A。

练习册系列答案
相关题目
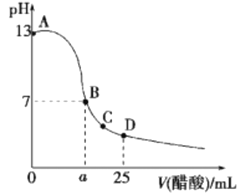
【题目】自催化作用是指反应物之一使该 反应速率加快的作用。用稀硫酸酸化的![]() 进行下列三组实验,一段时间后溶液均褪色(
进行下列三组实验,一段时间后溶液均褪色(![]() 可以记做
可以记做![]() )。
)。
实验① | 实验② | 实验③ |
|
|
|
褪色 | 比实验①褪色快 | 比实验①褪色快 |
下列说法不正确的是
A.实验①中发生氧化还原反应,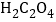 是还原剂,产物MnSO4能起自催化作用
是还原剂,产物MnSO4能起自催化作用
B.实验②褪色比①快,是因为MnSO4的催化作用加快了反应速率
C.实验③褪色比①快,是因为Cl-的催化作用加快了反应速率
D.若用![]() 的
的![]() 做实验①,推测比实验①褪色快
做实验①,推测比实验①褪色快