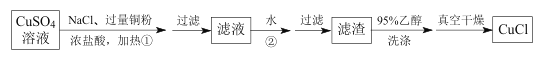
题目内容
【题目】根据VSEPR模型判断,下列微粒中所有原子都在同一平面上的是( )
A. SO32- 和NO2-B. NO3- 和SO32-C. ![]() 和ClO3-D. PO43- 和SO32-
和ClO3-D. PO43- 和SO32-
【答案】B
【解析】
离子中所有原子都在同一平面上,则离子的空间构型为直线形、V形或平面三角形,根据中心原子的价层电子对数判断分子的空间构型,价层电子对=σ键电子对+中心原子上的孤电子对,据此分析。
A. SO32-中S原子价层电子对个数=3+![]() =4,为四面体结构;NO2-中N原子价层电子对个数=2+
=4,为四面体结构;NO2-中N原子价层电子对个数=2+![]() =3,为三角锥形结构,都不是平面形结构的微粒,故A错误;
=3,为三角锥形结构,都不是平面形结构的微粒,故A错误;
B. NO3-中N原子价层电子对个数=3+![]() =3,为平面三角形结构;SO3中S原子价层电子对个数3+
=3,为平面三角形结构;SO3中S原子价层电子对个数3+![]() =3,为平面三角形结构,所有原子共平面,所以B选项是正确的;
=3,为平面三角形结构,所有原子共平面,所以B选项是正确的;
C.H3O+中O原子价层电子对个数=3+![]() =4,为四面体结构;ClO3-中Cl原子价层电子对个数=3+
=4,为四面体结构;ClO3-中Cl原子价层电子对个数=3+![]() =4,为四面体结构,所有原子不共平面,故C错误;
=4,为四面体结构,所有原子不共平面,故C错误;
D.PO43-中P原子价层电子对个数=4+![]() =4,为四面体结构;SO32-中S原子价层电子对个数=3+
=4,为四面体结构;SO32-中S原子价层电子对个数=3+![]() =4,为四面体结构,所有原子不共平面,故D错误。
=4,为四面体结构,所有原子不共平面,故D错误。
所以B选项是正确的。

【题目】下列变化中,气体反应物既被氧化又被还原的是
A.金属钠露置在空气中迅速变暗
B.露置在空气中的过氧化钠固体变白
C.将氨气与氯化氢混合,产生大量白烟
D.充满二氧化氮的试管倒扣在水槽中,试管内液面上升
【题目】(15分)碘及其化合物在合成杀菌剂、药物等方面具有广泛用途。回答下列问题:
(1)大量的碘富集在海藻中,用水浸取后浓缩,再向浓缩液中加MnO2和H2SO4,即可得到I2,该反应的还原产物为____________。
(2)上述浓缩液中含有I-、Cl-等离子,取一定量的浓缩液,向其中滴加AgNO3溶液,当AgCl开始沉淀时,溶液中![]() 为:_____________,已知Ksp(AgCl)=1.8×10-10,Ksp(AgI)=8.5×10-17。
为:_____________,已知Ksp(AgCl)=1.8×10-10,Ksp(AgI)=8.5×10-17。
(3)已知反应2HI(g) ===H2(g) + I2(g)的ΔH= +11kJ·mol-1,1mol H2(g)、1mol I2(g)分子中化学键断裂时分别需要吸收436kJ、151kJ的能量,则1molHI(g)分子中化学键断裂时需吸收的能量为______________kJ。
(4)Bodensteins研究了下列反应:2HI(g)![]() H2(g) + I2(g)
H2(g) + I2(g)
在716K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如下表:
t/min | 0 | 20 | 40 | 60 | 80 | 120 |
x(HI) | 1 | 0.91 | 0.85 | 0.815 | 0.795 | 0.784 |
x(HI) | 0 | 0.60 | 0.73 | 0.773 | 0.780 | 0.784 |
①根据上述实验结果,该反应的平衡常数K的计算式为:___________。
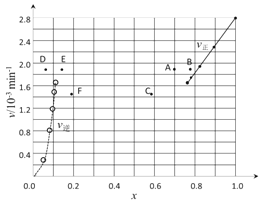
②上述反应中,正反应速率为v正= k正·x2(HI),逆反应速率为v逆=k逆·x(H2)·x(I2),其中k正、k逆为速率常数,则k逆为________(以K和k正表示)。若k正 = 0.0027min-1,在t=40min时,v正=________min-1
③由上述实验数据计算得到v正~x(HI)和v逆~x(H2/span>)的关系可用下图表示。当升高到某一温度时,反应重新达到平衡,相应的点分别为_________________(填字母)